Металлы - это класс веществ, которые характеризуются высокой проводимостью тепла и электричества, а также способностью образовывать ионы положительного заряда в реакциях. Химические свойства металлов определяют их способность реагировать с другими веществами, образовывать соединения и проявлять различные физические и химические свойства.
Одним из характерных свойств металлов является их способность реагировать с кислотами. Когда металл вступает в реакцию с кислотой, он отдает электроны, образуя ионы металла положительной валентности. Например, реакция между цинком и соляной кислотой приводит к образованию иона цинка и иона хлора:
Zn + 2HCl → ZnCl2 + H2
Еще одной важной реакцией металлов является их способность вступать в реакцию с кислородом, образуя оксиды. Реакция между железом и кислородом приводит к образованию оксида железа (Fe2O3), более известного как ржавчина:
4Fe + 3O2 → 2Fe2O3
Металлы также могут реагировать с водой, образуя гидроксиды и выделяя водород. Например, реакция между калием и водой приводит к образованию гидроксида калия (KOH) и выделению водорода:
2K + 2H2O → 2KOH + H2
Это только некоторые из множества реакций, в которых участвуют металлы. Изучение их химических свойств позволяет лучше понять и использовать металлы в различных областях науки и техники, а также в повседневной жизни.
Химические свойства металлов

Металлы являются одним из основных классов химических элементов и обладают рядом характерных химических свойств. Одно из главных свойств металлов - их способность образовывать ионные связи с неметаллами, образуя соли. Часто металлы обладают благородством, то есть они не реагируют с другими веществами при обычных условиях.
Большинство металлов обладают высокой электропроводностью и теплопроводностью. Это связано с их способностью образовывать электронные облака, которые могут легко передавать электрический ток и тепловую энергию. Некоторые металлы, такие как алюминий и медь, также обладают хорошей устойчивостью к коррозии.
Металлы могут реагировать с кислородом и образовывать оксиды. Например, железо может реагировать с кислородом и образовывать ржавчину, тогда как алюминий образует оксид, который защищает его от дальнейшей коррозии. Металлы также могут реагировать с кислотами и образовывать соли и выделять водород.
Другим важным свойством металлов является их способность вступать в реакцию с водой. Некоторые металлы, такие как натрий и калий, реагируют с водой с разделением ее на водород и гидроксид металла. Другие металлы, такие как цинк и алюминий, реагируют с водой только при наличии кислорода или кислоты.
Взаимодействие металлов с кислородом

Металлы обладают способностью взаимодействовать с кислородом. Кислород является активным элементом, который образует химические соединения с различными металлами.
Одной из наиболее известных реакций металлов с кислородом является окисление. В результате окисления металла образуется соединение, включающее кислород. Например, железо при взаимодействии с кислородом окисляется и образует оксид железа, который обычно имеет черный цвет и называется ржавчиной.
Взаимодействие металлов с кислородом может происходить и во время горения. Например, металлический магний активно реагирует с кислородом и горит с ярким светом при воздействии на него небольшого количества огня или искры. В результате реакции образуется оксид магния.
Некоторые металлы также способны образовывать перекисные соединения с кислородом. Например, натрий при взаимодействии с кислородом образует пероксид натрия. Этот реакционный продукт используется в качестве кислородного донора при подаче кислорода пациентам в медицинских целях.
В целом, взаимодействие металлов с кислородом является важной химической реакцией, которая приводит к образованию различных соединений, имеющих важные промышленные и биологические применения.
Реакции металлов с кислотами

Металлы обладают химическими свойствами, позволяющими им проявлять активность в реакциях с различными веществами. Одним из наиболее распространенных взаимодействий металлов является их реакция с кислотами. Кислоты – это вещества, способные отдавать протоны (водородные ионы) и реагировать с основаниями.
Когда металлы взаимодействуют с кислотами, образуются соответствующие соли и выделяется водород. Реакция металлов с кислотами является одной из наиболее распространенных и хорошо изученных.
Реакция металла с кислотой представляет собой взаимодействие металла с водородными ионами кислоты. Произойдет ли реакция между металлом и кислотой, зависит от активности металла и кислоты, а также от условий, в которых происходит взаимодействие.
Некоторые металлы реагируют с кислотами более активно и реакция протекает с выделением водорода. Это наблюдается, например, при взаимодействии цинка с соляной кислотой:
| Реакция | Уравнение реакции |
|---|---|
| Взаимодействие цинка с соляной кислотой | Zn + 2HCl = ZnCl2 + H2 |
Однако не все металлы реагируют с кислотами так активно. Например, медь не реагирует с обычными кислотами и не выделяет водород. Это объясняется более низкой активностью меди по сравнению с цинком.
Реакции металлов с кислотами являются важными с точки зрения промышленности и научных исследований. Они позволяют получать различные соли и исследовать свойства металлов, а также применять их в различных областях, таких как металлургия, химическая промышленность и электроэнергетика.
Взаимодействие металлов с водой

Многие металлы проявляют химическую активность при взаимодействии с водой. Это связано с их способностью к окислению и образованию ионов металла. При этом выделяется водородгаз, а металл может раствориться или образовать оксид. Взаимодействие металлов с водой может протекать различными способами и зависит от их активности.
Активные металлы, такие как натрий и калий, реагируют с водой взрывообразно. При контакте с водой они быстро взаимодействуют, образуя гидроксид металла и выделяя водород. Это явление можно наблюдать при эксперименте, когда нарезанный кусок натрия бросают в воду – образуется шипение и высвобождается водород.
Некоторые металлы, такие как железо и алюминий, тоже могут реагировать с водой, но гораздо медленнее. При этом вода способна разрушать метал постепенно, приводя к его коррозии. Это происходит благодаря наличию кислорода в воде, который окисляет металл.
Другие металлы, например, золото и платина, не реагируют с водой и не окисляются в ее присутствии. Это связано с их низкой активностью и стабильностью.
В целом, взаимодействие металлов с водой является важным физико-химическим процессом, который может использоваться в различных областях науки и техники. Например, реакция металлов с водой используется для получения водорода или при производстве электроэнергии в гальванических элементах.
Реакции металлов с неорганическими соединениями
Металлы, обладая высокой активностью, часто реагируют с неорганическими соединениями, проявляя свои химические свойства. Такие реакции имеют важное практическое значение и используются в различных областях, включая промышленность и науку.
Одним из примеров реакций металлов с неорганическими соединениями является реакция активных металлов с кислотами. Например, реакция металла цинка с соляной кислотой приводит к выделению водорода и образованию соли цинка. Это явление может быть объяснено способностью активных металлов отдавать свои электроны и образовывать положительные ионы.
Еще одной важной реакцией металлов с неорганическими соединениями является реакция с щелочами. Например, реакция калия с гидроксидом натрия приводит к образованию гидроксида калия и выделению водорода. Этот процесс особенно важен в промышленности для получения щелочных металлов и водорода.
Также металлы могут образовывать соединения с галогенами, например, хлором или бромом. При этом образуются соли, такие как хлориды или бромиды металлов. Например, реакция натрия с хлором приводит к образованию хлорида натрия.
Реакции металлов с неорганическими соединениями также применяются в аналитической химии для определения содержания металлов в различных материалах. В таких реакциях используются специальные реактивы, которые обладают способностью реагировать только с определенными металлами.
Таким образом, реакции металлов с неорганическими соединениями представляют собой важный аспект изучения химических свойств металлов и имеют практическое значение в различных областях науки и технологии.
Реакции металлов с органическими соединениями
Металлы могут образовывать различные реакции с органическими соединениями, что делает их полезными в различных промышленных процессах. Одной из наиболее известных реакций является горение металлов в органических веществах. Например, алюминий может гореть в кислороде, при этом образуя окись алюминия и выделяя большое количество тепла.
Реакция металлов с кислотами также является важным аспектом их взаимодействия с органическими соединениями. Некоторые металлы, такие как цинк или железо, реагируют с кислым окислителем, при этом выделяя водород. Такие реакции широко используются в промышленности для получения водорода или водородных соединений.
Также металлы могут образовывать комплексные соединения с органическими веществами, например, с аминокислотами. Это важно в биохимии, где комплексы металлов и органических соединений играют ключевую роль в многих биологических процессах, таких как транспорт кислорода или катализ химических реакций.
Некоторые металлы также могут образовывать реакции с органическими соединениями, которые могут привести к образованию новых веществ. Например, реакция алюминия с хлоридами органических соединений приводит к образованию галоидов металлов, которые находят применение в качестве катализаторов или межпланетных топлив.
Важно отметить, что реакции металлов с органическими соединениями могут быть опасными и требуют предосторожности. Некоторые металлы могут быть токсичными и нестабильными в органических средах, поэтому проведение таких реакций должно происходить под контролем и в соответствии с правилами безопасности.
Примеры химических реакций металлов
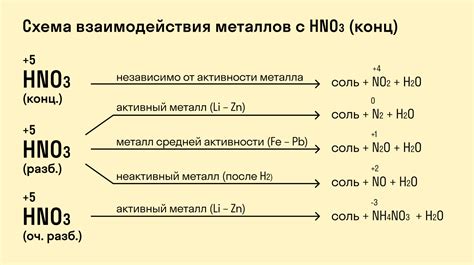
Металлы обладают различными химическими свойствами и могут проявлять активную реакционность при контакте с другими веществами. Ниже приведены примеры некоторых химических реакций металлов:
1. Реакция железа с кислородом: при взаимодействии железа с кислородом образуется оксид железа. Эта реакция наблюдается в процессе коррозии железных предметов, когда металл вступает в контакт с водой и кислородом из воздуха.
2. Реакция цинка с серной кислотой: при реакции цинка с серной кислотой образуется сульфат цинка и выделяется водород. Эта реакция широко используется в лабораторной практике для получения водорода.
3. Реакция меди с азотной кислотой: при взаимодействии меди с азотной кислотой образуется нитрат меди и выделяется оксид азота. Эта реакция может быть использована для получения нитрата меди.
4. Реакция алюминия с хлором: при реакции алюминия с хлором образуется хлорид алюминия. Эта реакция может быть использована в производстве химических соединений на основе алюминия.
5. Реакция свинца с серной кислотой: при взаимодействии свинца с серной кислотой образуется сульфат свинца и выделяется водород. Эта реакция может быть использована для получения сульфата свинца в химической промышленности.
Решение задач по химическим свойствам металлов
При решении задач по химическим свойствам металлов необходимо обратить внимание на их положение в периодической таблице элементов. Металлы расположены слева от ступеньчатой линии и включают в себя такие элементы, как натрий, железо, алюминий, медь и многие другие.
Одним из распространенных видов задач является определение активности металла. Для этого нужно учитывать реакцию металла с кислотами. Чем сильнее металл реагирует с кислотой, тем выше его активность. Например, если металл образует соляные соли и выделяет водород, то он является активным. Однако, если металл не реагирует с кислотой или реагирует очень медленно, то он считается неметаллом или малоактивным металлом.
Другим типом задач является определение способности металла образовывать ионы. Металлы, находящиеся выше в ряду активности, образуют положительные ионы, способные вступать в реакции с отрицательно заряженными ионами. Например, натрий образует положительные ионы Na+, которые могут образовывать соли с отрицательными ионами, такими как Cl-. Кроме того, металлы могут образовывать сплавы с другими металлами, такие как бронза или латунь, что также можно учитывать при решении задач.
При решении задач по химическим свойствам металлов важно учитывать не только их реакции, но и физические характеристики, такие как плотность, плавление и кипение. Также необходимо помнить о том, что свойства металлов могут быть изменены при воздействии на них других химических веществ или изменении условий реакции.
Вопрос-ответ

Какие химические реакции происходят у металлов?
Металлы могут проявлять различные химические реакции, такие как окисление, растворение в кислотах, образование солей и сплавов. Например, многие металлы, такие как железо и алюминий, подвергаются окислению при взаимодействии с кислородом воздуха, образуя окисные пленки на своей поверхности. Они также могут растворяться в кислотах, образуя соли и выделяя водород. Металлы могут образовывать также сплавы с другими металлами, что позволяет им придавать им новые свойства и использовать в различных отраслях промышленности.
Каким образом металлы реагируют с кислородом?
Металлы могут реагировать с кислородом, образуя окисные пленки на своей поверхности. Например, железо, подвергнутое окислению, образует ржавчину или окисную пленку, алюминий образует оксид алюминия. Реакция металлов с кислородом может происходить при нагревании или взаимодействии с воздухом влажным или содержащим кислород.
Как металлы взаимодействуют с кислотами?
Многие металлы взаимодействуют с кислотами, образуя соли и выделяя водород. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водород. Железо может растворяться в серной кислоте, образуя сульфат железа и выделяя водород. Реакция металлов с кислотами может происходить при нагревании или простом взаимодействии.
