Металлы – это особый класс химических элементов, обладающих рядом уникальных свойств, отличающих их от других элементов. Они обладают высокой тепло- и электропроводностью, гибкостью, блеском и твердостью. Кроме того, металлы обладают способностью образовывать ионы положительных зарядов, что дает им способность становиться источником электронов.
Одной из ключевых химических характеристик металлов является их реакционная способность. Металлы легко вступают в химические реакции, особенно с кислородом и водой. Например, при контакте с воздухом многие металлы реагируют с кислородом, образуя оксиды. Реакция металла с кислородом может сопровождаться выделением тепла и света, что называется горением.
Другой важной химической особенностью металлов является их способность к ионизации. Металлы могут легко отдавать электроны, образуя положительно заряженные ионы. Поэтому многие металлы, такие как натрий, калий, магний и алюминий, способны взаимодействовать с кислородом воды и вытеснять из нее водород. Эта способность металлов к ионизации делает их важнейшими реагентами в многих процессах, таких как органические синтезы и электрохимические реакции.
Интересно, что многие металлы способны образовывать соединения не только с кислородом, но и с другими элементами. Например, железо может образовывать соединения с серой, фосфором и другими неметаллами. Эти соединения являются важными частями многих биологических систем, включая гемоглобин – вещество, отвечающее за перенос кислорода в организме.
Таким образом, химические свойства металлов делают их важными компонентами многих процессов и материалов. Изучение этих свойств имеет большое значение для развития науки и промышленности.
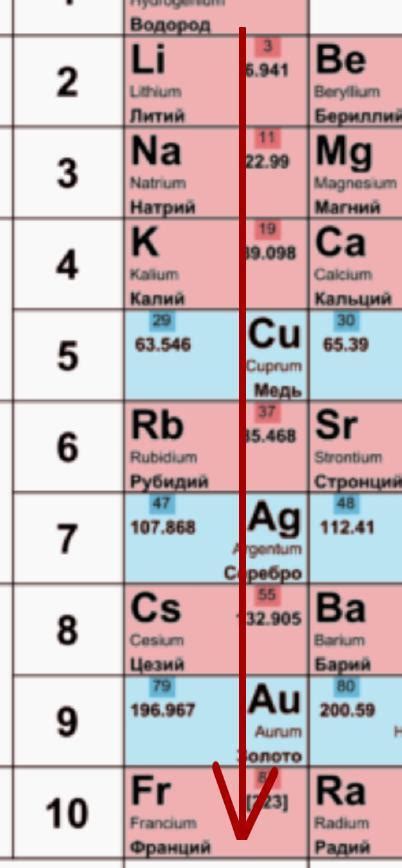
Металлы и их свойства

Металлы - это элементы, обладающие специфическими химическими и физическими свойствами. Главные характеристики металлов - их проводимость тепла и электричества, блеск и хорошая тугоплавкость.
Важным свойством металлов является их способность образовывать положительные ионы, т.е. катионы. Это связано с высокой электронной проводимостью металлов, что обусловлено наличием свободных электронов в валентной зоне. Большинство металлов реагируют с водой и кислородом, хотя некоторые металлы, как например золото, платина и серебро, не вступают в реакцию с кислородом при обычных условиях.
Металлы обладают высокой термической и электрической проводимостью. Это объясняется наличием свободных электронов, которые могут простираться по всей структуре металла и переносить тепло и электричество. Именно благодаря этому свойству металлы широко используются в различных сферах: от производства электроники до строительства и авиации.
Большинство металлов обладает хорошей тугоплавкостью, то есть способностью выдерживать высокую температуру без разрушения. Это связано с сильными металлическими связями между атомами и энергией, необходимой для их разрыва. Некоторые металлы, особенно щелочные и щелочноземельные, очень мягкие и низкоплавкие, что позволяет их легко обрабатывать и использовать в различных видах производства.
Физические свойства:

Металлы обладают рядом характерных физических свойств, которые делают их уникальными и широко используемыми в различных сферах деятельности.
Проводимость электричества и тепла: Металлы являются хорошими проводниками электричества и тепла. Это связано с наличием свободных электронов, которые легко перемещаются по их структуре.
Упругость и пластичность: Металлы обладают высокой упругостью и пластичностью, что позволяет им принимать различные формы и подвергаться деформации без разрушения.
Плотность: Металлы обычно обладают высокой плотностью. Например, плотность железа составляет около 7,9 г/см³, а плотность платины – около 21,4 г/см³.
Твердость: Металлы, в зависимости от своей структуры и свойств, могут обладать различной твердостью. Например, медь относительно мягкая, а алмаз – один из самых твердых материалов на Земле.
Температура плавления: У металлов высокая температура плавления, что связано с особенностями их кристаллической структуры и силами, держащими атомы вещества в кристаллической решетке. Например, у железа температура плавления составляет около 1538 градусов Цельсия.
Химическая активность
Химическая активность металлов определяется их способностью взаимодействовать с другими веществами. Она зависит от электрохимического потенциала, который характеризует склонность металла к окислению или восстановлению. Большинство металлов обладают высокой химической активностью и легко реагируют с кислородом, кислотами и другими химическими веществами.
Металлы могут образовывать соединения с различными элементами. Особенно активные металлы, такие как натрий и калий, реагируют с водой, образуя гидроксиды и выделяя водород. Некоторые металлы, например железо, образуют оксиды при взаимодействии с кислородом из воздуха.
Химическая активность металлов также проявляется в способности образовывать сплавы. Сплавы представляют собой гомогенные смеси двух или более металлов, которые характеризуются новыми свойствами исходных веществ. Часто металлы сплавляют для получения материалов с определенными механическими или электрическими свойствами.
Химическая активность металлов играет важную роль в различных процессах, таких как окисление, восстановление, коррозия и сплавление. Понимание химической активности металлов позволяет предсказывать и контролировать их реакции и использовать металлы в различных областях промышленности и научных исследований.
Коррозионная стойкость:

Коррозионная стойкость – это способность металла сохранять свои физические и химические свойства при контакте с агрессивными средами. Коррозия – это процесс разрушения и изменения структуры металла под воздействием окружающей среды, что может привести к ухудшению его свойств и потере функциональности.
Различные металлы имеют разную степень коррозионной стойкости. Например, нержавеющая сталь обладает высокой коррозионной стойкостью благодаря содержанию в составе хрома, который образует пассивную пленку на поверхности металла, защищающую его от окисления и ржавления.
Алюминий также является коррозионностойким металлом благодаря образованию на его поверхности тонкого оксидного слоя, который предотвращает дальнейшее окисление. Однако, при воздействии кислот и щелочей алюминий может быть подвержен коррозии.
Оценка коррозионной стойкости металла проводится с помощью специальных испытаний и тестов. Результаты этих испытаний помогают разработчикам и производителям выбрать оптимальный материал для конкретного применения с учетом особенностей окружающей среды.
Реакция с кислотами:

Металлы реагируют с кислотами, образуя соли и выделяя водород. При этом образуется химическое соединение – соль, которая представляет собой ионную решетку, состоящую из положительных металлических ионов и отрицательных анионов кислоты.
Реакция металла с кислотой протекает с выделением водорода. При этом металл замещает водород в кислоте.
Реактивность металлов по отношению к кислотам зависит от их положения в ряду напряжений. Более реакционноспособные металлы замещают менее реакционноспособные из солей.
Расторжение металлами связи воды происходит с выделением молекулярного водорода и образованием гидроксида металла (основания). Чем более реакционноспособным является металл, тем сильнее щелочное свойство его оксидов.
Металлы группы 1 (щелочные металлы) и группы 2 (щелочноземельные металлы) реагируют с кислотами, образуя соответствующие соли и выделяя водород. Например, натрий реагирует с серной кислотой с образованием сульфата натрия и выделением водорода.
- Натрий + серная кислота = сульфат натрия + водород
Некоторые металлы могут реагировать не только с минеральными, но и с органическими кислотами. Например, алюминий реагирует с уксусной кислотой с образованием ацетата алюминия и выделением водорода:
- Алюминий + уксусная кислота = ацетат алюминия + водород
Таким образом, реакция металлов с кислотами представляет собой обменные реакции, при которых металлы замещают водород в кислоте, образуя соли и выделяя водород в виде газа.
Способы обработки:
1. Пахтовка: Один из основных способов обработки металлов, включающий нанесение защитного слоя на поверхность металла. Пахтовка позволяет предотвратить коррозию, улучшить внешний вид металла и увеличить его срок службы.
2. Полировка: Этот способ обработки металлов используется для придания поверхности металла гладкости и блеска. В процессе полировки удаляются мелкие царапины и неровности, что делает металл более привлекательным.
3. Гальваническое покрытие: Метод, при котором на поверхность металла наносится покрытие другого металла путем электрохимического осаждения. Это позволяет улучшить защитные свойства металла и изменить его внешний вид.
4. Термообработка: Процесс, включающий нагрев металла до определенной температуры с последующим охлаждением. Термообработка позволяет изменить структуру металла, что влияет на его механические свойства.
5. Химическая обработка: Включает в себя использование химических реактивов для изменения поверхности металла. Например, анодирование алюминия или обезжиривание перед окрашиванием.
6. Литье: Метод, при котором расплавленный металл заливается в форму и затвердевает, образуя желаемую форму детали. Литье позволяет получать сложные по форме и конфигурации изделия, которые трудно получить другими способами обработки металла.
Практическое применение:

Металлы имеют широкое практическое применение в различных отраслях промышленности и науки. Они используются для создания различных конструкций, механизмов и устройств.
Главное преимущество металлов - их высокая прочность и устойчивость к механическим нагрузкам. Благодаря этим свойствам металлы широко применяются в строительстве и машиностроении. Они используются для создания каркасов зданий, мостов, автомобилей, самолетов, судов и других транспортных средств. Металлы также используются для создания механических деталей, таких как винты, гайки, пружины, шестерни и другие элементы, необходимые для работы различных механизмов.
Кроме того, металлы широко применяются в электротехнике и электронике. Они используются для создания проводов, кабелей и контактов, которые обеспечивают электрическую связь в различных устройствах. Металлы также используются для создания электронных компонентов, таких как микрочипы и транзисторы.
Некоторые металлы имеют прекрасные термические свойства, что делает их идеальными материалами для создания инженерных систем отопления, охлаждения и кондиционирования воздуха. Металлы также используются для создания котлов, радиаторов, трубопроводов и других элементов систем отопления и водоснабжения.
Благодаря своей химической стойкости, некоторые металлы используются в производстве реакторов, емкостей и оборудования для химической промышленности. Эти металлы устойчивы к агрессивным средам и высоким температурам, что делает их незаменимыми в процессах синтеза и переработки химических веществ.
Вопрос-ответ

Каким образом металлы реагируют с кислородом?
Металлы могут реагировать с кислородом и образовывать оксиды. Реакция металла с кислородом может происходить при нагревании, сопровождаясь испусканием тепла и иногда света. Некоторые металлы, такие как натрий и калий, реагируют со сравнительно низкими температурами. Оксиды металлов обычно обладают основными свойствами.
Какова реакция металлов с кислотами?
Металлы могут реагировать с кислотами, образуя соль и выделяя водород. Реактивность металлов с кислотами зависит от их электрохимического потенциала. Например, активные металлы, такие как натрий и калий, реагируют с кислотами очень быстро, при этом происходит интенсивное выделение водорода и образование солей.
Можно ли восстановить металлы с помощью других металлов?
Да, металлы могут быть восстановлены за счет реакции с другими металлами. Например, активные металлы, такие как цинк и алюминий, могут реагировать с ионами металлов в растворе, образуя металлические отложения. Это явление называется гальванической реакцией или металлическим осаждением.
Что происходит при реакции металлов с неактивными газами?
Реакция металлов с неактивными газами, такими как азот или водород, может происходить только при высоких температурах и под давлением. При этом образуются металлические нитриды, карбиды или гидриды. Реакция металлов с газами является важным процессом в промышленности для получения различных соединений.
Какие соединения металлов демонстрируют кислотные свойства?
Некоторые соединения металлов, такие как алюминий оксихлорид и некоторые оксиды и гидроксиды, могут обладать кислотными свойствами. Когда эти соединения взаимодействуют с основаниями, они образуют соли и выделяют воду.
