Процесс взаимодействия металла с раствором соли менее активного металла – это необычное и интересное явление, которое часто наблюдается в химических реакциях. При этом металл, который является более активным, вытесняет из раствора металл, обладающий меньшей активностью. Несмотря на то, что данная реакция может протекать довольно быстро и без видимых изменений, она имеет ряд особенностей, которые стоит учесть.
Одной из основных особенностей реакции металла с раствором соли менее активного металла является изменение цвета раствора. Обычно раствор соли менее активного металла имеет свою специфическую окраску, которая может быть интенсивной или бледной. Однако, когда в растворе начинает происходить реакция с более активным металлом, цвет раствора может измениться, что является одним из показателей протекания процесса.
Реакция металла с раствором соли менее активного металла можно рассматривать на примере нескольких пар металлов. Например, если в растворе ионов меди(II) присутствует серебро, то процесс взаимодействия будет проходить следующим образом: серебро будет вытеснять ионы меди и восстанавливаться до металлического состояния, что приводит к образованию осадка серебра. Аналогичные реакции можно наблюдать и на примере других пар металлов.
Основные принципы реакции
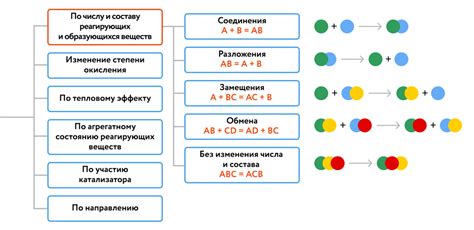
Реакция металла с раствором соли менее активного металла основана на принципе замещения одного металла другим. Это явление называется дисплейсментной реакцией или реакцией замещения. В этой реакции более активный металл замещает менее активный металл в растворе его соли.
Основным условием для возникновения реакции замещения является разность активностей металлов. При этом, более активный металл должен находиться в растворе со своей солью, а менее активный металл – в виде отдельного элемента.
Наиболее простым примером такой реакции является реакция железа с раствором медного (II) сульфата. В этом случае, железо, будучи более активным металлом, замещает медь в растворе ее сульфата. Реакция идет по следующему уравнению:
| Fe + CuSO4 → FeSO4 + Cu |
|---|
Реакция замещения может протекать и с образованием осажденного продукта. Например, при реакции цинка с раствором свинца (II) нитрата, цинк замещает свинец в растворе его нитрата, а также образуется осадок цинка. Уравнение реакции имеет следующий вид:
| Zn + Pb(NO3)2 → Zn(NO3)2 + Pb |
|---|
Основные принципы реакции металла с раствором соли менее активного металла связаны с возможностью замещения металла в растворе его соли и образования новых продуктов реакции.
Влияние электрохимической активности металлов на реакцию

Реакция металла с раствором соли менее активного металла зависит от их электрохимической активности. Электрохимическая активность металла определяется его способностью участвовать в электрохимических процессах, основанных на переносе электронов. Металлы могут быть разделены на две группы: активные и менее активные.
Активные металлы, такие как натрий, калий и литий, имеют высокую электрохимическую активность. Они легко отдают свои электроны и образуют положительные ионы в растворе соли. При реакции с раствором соли менее активного металла, электрохимически активный металл замещает менее активный металл в соответствующем реакционном уравнении.
Например, при реакции меди с раствором соли цинка, происходит замещение цинка медью:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
В этом случае медь, которая является более активным металлом, отдает свои электроны цинку и замещает его в растворе соли. Это явление называется реакцией замещения или реакцией сопряжения.
Менее активные металлы, такие как свинец, железо и медь, имеют более низкую электрохимическую активность. Они не так легко отдают свои электроны и не могут замещать более активный металл в растворе соли. Поэтому реакции металлов с растворами солей менее активного металла, как правило, не происходят.
Влияние электрохимической активности металлов на реакцию с раствором соли менее активного металла является основой для понимания и предсказания химических реакций, происходящих в электрохимических процессах.
Примеры реакции металла с раствором соли менее активного металла
Реакция металла с раствором соли менее активного металла часто наблюдается в химических экспериментах и используется в промышленности для получения различных веществ. В таких реакциях активный металл вытесняет менее активный металл из его соли, что приводит к образованию новой соли и осаждению металла.
Один из примеров такой реакции - реакция цинка с раствором меди(II)сульфата. При взаимодействии цинка с раствором сульфата меди образуется осадок меди, а цинк переходит в ионное состояние, создавая новую соль - цинксульфат. Реакция выглядит следующим образом:
Zn + CuSO4 → Cu + ZnSO4
Другим примером реакции металла с раствором соли менее активного металла является реакция железа с раствором меди(II)сульфата. В данном случае железо вытесняет медь из ее соли, образуя осадок меди и новую соль - железосульфат. Реакция записывается следующим образом:
Fe + CuSO4 → Cu + FeSO4
Факторы, влияющие на скорость и интенсивность реакции

1. Концентрация реагентов. Скорость реакции зависит от концентрации реагентов в растворе. Чем выше концентрация, тем больше молекул, способных взаимодействовать друг с другом, и, соответственно, тем выше скорость реакции.
2. Температура. Повышение температуры увеличивает скорость реакции, так как повышение температуры приводит к увеличению энергии молекул и их скорости движения. Это увеличивает вероятность встречи активных центров реагентов и, следовательно, увеличивает скорость реакции.
3. Площадь поверхности реагентов. Чем больше площадь поверхности реактивных веществ, тем больше контакта между ними и, как следствие, тем выше скорость реакции.
4. Катализаторы. Катализаторы способны ускорять реакцию, не участвуя в ней. Они понижают энергию активации, необходимую для протекания реакции, тем самым повышая скорость и интенсивность реакции.
5. PH среды. Реакции могут происходить с разной скоростью в разных средах в зависимости от их кислотности или щелочности. Например, некоторые реакции могут быть более интенсивными в кислой среде, в то время как другие – в щелочной.
6. Масса реагентов. Чем больше масса реагентов, тем больше вещества доступно для реакции и тем выше скорость и интенсивность реакции.
7. Наличие света. В некоторых реакциях свет может влиять на скорость и интенсивность реакции. Например, фотохимические реакции могут происходить только при наличии света, что значительно повышает их скорость.
Практическое применение реакции

Реакция металла с раствором соли менее активного металла имеет различные практические применения. Во-первых, данный тип реакции широко используется в области электрохимии. Например, в процессе гальванического осаждения основных металлов на поверхности предметов для защиты от коррозии. Реакция металла более активного металла с раствором соли менее активного металла позволяет создавать электрохимические элементы, такие как гальванические элементы и аккумуляторы.
Также реакция металла с раствором соли менее активного металла находит применение в химическом анализе и определении содержания определенных элементов в пробах. Например, метод Вольгарта позволяет определять степень окисления двух присутствующих металлов на основе результатов реакции металла с раствором соли менее активного металла. Этот метод активно используется в аналитической химии для определения состава смесей и растворов.
Другим примером практического применения реакции металла с раствором соли менее активного металла является использование ее в процессе гальванического покрытия металлов. Например, благодаря данной реакции можно нанести покрытие цинком на поверхность изделий из стали для защиты от коррозии. Этот метод применяется в автомобильной промышленности для создания гальванических покрытий на автодеталях.
Сравнение с другими типами реакций

Реакция металла с раствором соли менее активного металла отличается от других типов реакций по ряду особенностей.
- При такой реакции образуется осадок, который может быть видимым глазу или микроскопическим.
- Рассматриваемый тип реакции может происходить только при наличии в растворе соли менее активного металла.
- Реакция металла с раствором соли менее активного металла протекает с выделением энергии в виде тепла и света.
Сравнивая с другими типами реакций, например, реакцией металла с кислотой, можно отметить следующие различия:
- Реакция металла с раствором соли менее активного металла происходит в водном растворе, тогда как реакция металла с кислотой происходит в кислотной среде.
- При реакции металла с кислотой образуется соль и выделяется водород, в то время как при реакции металла с раствором соли менее активного металла образуется осадок соли.
- Реакция металла с кислотой может протекать без сопровождающего выделения энергии в виде тепла и света.
Таким образом, реакция металла с раствором соли менее активного металла имеет свои уникальные особенности, которые отличают ее от других типов реакций с металлами.
Вопрос-ответ

Что происходит при реакции металла с раствором соли менее активного металла?
При реакции металла с раствором соли менее активного металла происходит обмен ионами, в результате которого менее активный металл вытесняется из раствора соли активным металлом. Наиболее активный металл будет находиться в растворе в ионной форме, а менее активный металл образует осадок.
Какие металлы могут реагировать с растворами солей менее активных металлов?
Металлы, которые имеют большую активность, способны реагировать с растворами солей менее активных металлов. К таким металлам можно отнести, например, цинк (Zn), железо (Fe), магний (Mg) и алюминий (Al). Они могут вытеснить из раствора ионы менее активных металлов, таких как медь (Cu) или свинец (Pb), и образовать осадок.
