Химия является одной из наук, которая изучает взаимодействия различных веществ, включая металлы и комплексы. Особое внимание при этом уделяется химическим реакциям, которые происходят с металлами в роли восстановителя. В результате таких реакций происходит изменение окислительного состояния металла, а также сопутствующие ему изменения в структуре и свойствах вещества.
Металлы-восстановители, такие как железо, цинк, алюминий и другие, обладают способностью передавать электроны другим веществам. Это означает, что они снижают свое окислительное состояние, а окислители, в свою очередь, повышают его. В результате происходит реакция, которая может привести к образованию новых веществ с измененными свойствами.
Исследования химических реакций металлов-восстановителей приводят к созданию новых материалов, а также помогают в разработке новых технологических процессов. Например, аллюминиевые сплавы, полученные благодаря реакции алюминия с другими веществами, отличаются высокой прочностью и легкостью. В результате, они находят широкое применение в авиационной и автомобильной промышленности.
Важной особенностью химических реакций металлов-восстановителей является не только изменение состояния металла, но и его способность вступать во взаимодействие с другими веществами. На основе этих реакций создаются различные соединения, которые обладают разнообразными свойствами. Это позволяет использовать металлы-восстановители не только в технике и промышленности, но и в медицине, а также в процессах очистки воды и воздуха.
Таким образом, изучение химических реакций металлов-восстановителей открывает перед нами увлекательный мир возможностей и позволяет применять новые знания на практике. Это помогает развитию различных отраслей науки и техники, а также способствует улучшению качества нашей жизни.
Химические реакции металлов-восстановителей: увлекательный мир взаимодействия веществ

Химические реакции металлов-восстановителей - это захватывающее путешествие в мир взаимодействия химических веществ. Металлы-восстановители, такие как цинк, железо, алюминий и многие другие, обладают способностью передавать электроны в окружающую среду, которая, в свою очередь, обогащается электронами и происходят стимулирующие химические реакции.
В химии существует множество примеров химических реакций металлов-восстановителей. Например, взаимодействие цинка с серной кислотой приводит к выделению водорода и образованию сульфата цинка. Это типичная реакция, в которой идет перенос электронов от цинка на водород, что помогает наблюдать процесс восстановления вещества.
Одной из интересных и зрелищных реакций металлов-восстановителей является взаимодействие алюминия с кислотой. При этом происходит интенсивное выделение водорода и образование соли алюминия, а сам алюминий может испариться и выплыть на поверхность раствора, создавая неповторимую картину «кипящего» раствора. Этот процесс возможен благодаря способности алюминия отдавать электроны и образованию газа.
Химические реакции металлов-восстановителей обладают не только научной, но и практической значимостью. Они широко применяются в различных областях, включая промышленность, электроэнергетику, медицину и даже в повседневной жизни. Благодаря этим реакциям были разработаны новые технологии, основанные на использовании металлов-восстановителей, что делает их изучение увлекательным и полезным.
Что такое химические реакции металлов-восстановителей?

Химические реакции металлов-восстановителей – это процессы, в которых металлы выполняют роль восстановителей, передавая электроны другим веществам и изменяя свою окислительную степень. В результате таких реакций металлы могут окисляться или восстановлены в химических соединениях.
Металлы-восстановители обладают способностью отдавать электроны более электроотрицательным веществам. Эти реакции широко применяются в различных отраслях науки и промышленности, таких как электролиз, гальваническое покрытие, химический синтез и даже в биологических процессах.
При химической реакции металл-восстановитель меняет свою окислительную степень путем добавления или удаления электронов. В результате металл может участвовать в образовании новых химических соединений или изменять свои физические и химические свойства.
Важно отметить, что металлы-восстановители часто реагируют с окислителями, превращая их в соединения с более низкой окислительной степенью. Такие реакции могут быть описаны с помощью окислительно-восстановительных реакций, в которых восстановитель и окислитель обмениваются электронами, причем металл-восстановитель отдает электроны, а окислитель получает их.
Особенности и примеры химических реакций металлов-восстановителей
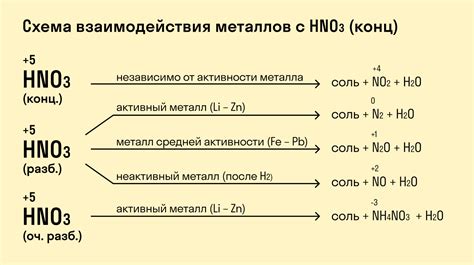
Химические реакции металлов-восстановителей представляют собой процессы, в которых металлы передают электроны другим веществам, окисляясь при этом. Такие реакции обладают рядом особенностей, которые делают их интересными и привлекательными для изучения.
Во-первых, металлы-восстановители обладают способностью легко отдавать электроны, поэтому эти реакции протекают в достаточно широком диапазоне условий. Важным фактором для протекания реакции является потенциал окисления металла, который определяет его способность вступать в реакцию. Например, цинк (Zn) обладает низким потенциалом окисления, поэтому может служить хорошим восстановителем в реакциях с многими веществами.
Во-вторых, химические реакции металлов-восстановителей могут происходить как в растворе, так и на поверхности твердого вещества. Например, алюминий (Al) может взаимодействовать с кислородом в воздухе, образуя оксид алюминия (Al2O3) на поверхности металла. Эта реакция является одним из примеров окисления металлов-восстановителей.
Также, реакции металлов-восстановителей часто сопровождаются выделением газов. Например, реакция металла цинка (Zn) с соляной кислотой (HCl) приводит к выделению водорода (H2) и образованию хлорида цинка (ZnCl2). Данная реакция является примером химического взаимодействия металлов с кислотами.
В заключение, химические реакции металлов-восстановителей представляют интерес не только с практической точки зрения, но и с научной. Изучение этих реакций позволяет лучше понять химические процессы, происходящие в природе и в промышленности, а также найти новые способы использования металлов в различных областях жизни.
Роль металлов-восстановителей в промышленности

Металлы-восстановители играют важную роль в промышленности, используя свои свойства, они способны изменять состав и свойства веществ. Они широко применяются в различных областях промышленности, таких как металлургия, электроника, фармацевтика и другие.
В металлургии металлы-восстановители используются для производства и очистки металлов. Они используются для снижения окислительного состояния металла и удаления нежелательных примесей. Например, алюминий используется как восстановитель для производства чистого железа из его руды.
В электронике металлы-восстановители играют роль в производстве полупроводниковых приборов. Они применяются для резкого изменения проводимости электричества и создания контактов между различными слоями полупроводниковых материалов. Например, восстановление золота используется для создания тонких металлических проводников на чипах компьютеров.
В фармацевтике металлы-восстановители используются для получения и очистки препаратов. Они способны изменять структуру и свойства органических молекул, что позволяет создавать новые лекарственные препараты. Например, никель используется как восстановитель при синтезе различных лекарственных веществ.
Металлы-восстановители также находят применение в процессах обогащения полезных ископаемых, сжигании топлива, производстве целлюлозы и бумаги, а также во многих других отраслях промышленности.
Практическое применение химических реакций металлов-восстановителей в повседневной жизни

Химические реакции с участием металлов-восстановителей широко применяются в повседневной жизни. Одним из таких примеров является использование алюминия в процессе восстановления окрашенных предметов. Путем окисления алюминия можно удалять краску с поверхности металлических деталей, что позволяет восстановить их первоначальный вид.
Еще одним применением химических реакций металлов-восстановителей является использование железа в процессе очистки воды от железа и марганца. При взаимодействии с кислородом железо окисляется и выпадает в виде осадка, который затем можно легко удалить. Такая реакция позволяет улучшить качество питьевой воды и предотвратить образование нежелательных отложений в трубопроводах и системах водоснабжения.
Также, реакции с участием металлов-восстановителей применяются в процессе получения электроэнергии. Батарейки различного типа, такие как щелочные и литиевые, основаны на реакциях окисления-восстановления металлических веществ. При этом происходит преобразование химической энергии в электрическую, что позволяет использовать энергию батареек для питания различных устройств и приборов.
Кроме того, химические реакции металлов-восстановителей применяются в производстве различных материалов и изделий. Например, в процессе производства стали используется реакция окисления-восстановления металлов, таких как железо и углерод. Эта реакция позволяет получить материал с определенными механическими свойствами, что делает его применимым для строительства, машиностроения и других отраслей.
Вопрос-ответ

Что такое металл-восстановитель?
Металл-восстановитель - это металл, который способен передавать электроны другим веществам в химических реакциях. Он может выступать в роли окислителя, принимая электроны от других веществ и тем самым окисляясь сам.
Какие металлы являются самыми активными восстановителями?
Самыми активными металлами-восстановителями являются щелочные металлы, такие как литий, натрий, калий. Они очень реактивны и легко окисляются, передавая свои электроны в химических реакциях.
Какие химические реакции можно проводить с металлами-восстановителями?
С металлами-восстановителями можно проводить множество интересных и полезных химических реакций. Например, они способны взаимодействовать с кислородом и водой, образуя оксиды и гидроксиды. Они также могут вступать в реакцию с различными кислотами, образуя соли и выделяя водородный газ.
Какие применения могут быть у металлов-восстановителей?
Металлы-восстановители широко используются в промышленности и научных исследованиях. Например, они могут использоваться в производстве батареек, взрывчатых веществ, сплавов и многих других материалов. Они также могут быть использованы для очистки воды и в процессе синтеза органических соединений.
Какие безопасностные меры нужно соблюдать при работе с металлами-восстановителями?
При работе с металлами-восстановителями необходимо соблюдать определенные безопасностные меры, так как они могут быть опасными в обращении. Например, нужно работать в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать ингаляции газов. Также необходимо использовать средства индивидуальной защиты, например, защитные очки и перчатки, чтобы избежать контакта с веществами.
