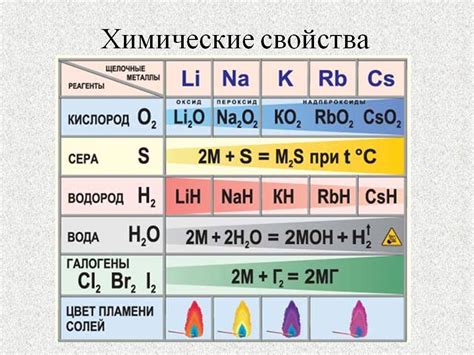
На уроках химии в 9 классе одной из основных тем является изучение химических реакций металлов. Металлы - это важный класс веществ, имеющих широкое применение в нашей жизни. Они не только используются в производстве различных предметов, но и играют важную роль в химических реакциях.
Ключевым понятием при изучении химических реакций металлов является окисление-восстановление. Металлы могут окисляться и восстанавливаться, образуя при этом различные соединения. Окисление - это процесс, при котором металл отдает электроны, а восстановление - процесс, при котором металл получает электроны. Эти процессы происходят в реакциях с окислителями и восстановителями соответственно.
Например, реакция железа с кислородом приводит к образованию окиси железа(III):
4Fe + 3O2 → 2Fe2O3
В процессе изучения химических реакций металлов учащиеся также узнают о металлической активности. Металлы различаются по своей активности, и это важное свойство, которое влияет на их способность взаимодействовать с другими веществами. Некоторые металлы, такие как натрий и калий, являются очень активными и быстро реагируют с водой или кислотами. Другие, такие как железо или медь, не так активны и могут реагировать только с определенными веществами или при определенных условиях.
Изучение химических реакций металлов не только позволяет учащимся понять основы химии, но и обеспечивает им знания, необходимые для понимания различных процессов, происходящих в нашей окружающей среде. Это также поможет им в будущем, когда они смогут применять свои знания о химии в реальной жизни.
Важность изучения химических реакций металлов

Изучение химических реакций металлов является важным блоком на уроках химии в 9 классе. Это связано с тем, что металлы являются основой многих промышленных процессов и имеют широкое применение в нашей жизни.
Во-первых, знание химических реакций металлов позволяет понять, как происходит окисление или восстановление металлов, что является основой коррозии. Это позволяет разработать методы защиты металлических конструкций от разрушения и сохранить их долговечность.
Во-вторых, изучение химических реакций металлов позволяет понять, как происходит образование и свойства различных металлических соединений. Некоторые из них имеют важное промышленное значение, например, железо - основной компонент стали, алюминий - легкий и прочный металл, используемый в авиационной и строительной отраслях.
Также изучение химических реакций металлов позволяет понять, как металлы взаимодействуют с другими веществами. Например, реакция металлов с кислотами может быть использована для получения водорода, а реакция металлов с солями может служить методом выделения металлов из руды.
Изучение химических реакций металлов также позволяет развивать навыки анализа и экспериментирования. Учащиеся могут проводить практические работы, наблюдать и описывать химические реакции металлов, проводить исследования и делать выводы. Это развивает их научное мышление и способности к самостоятельной работе.
- Изучение химических реакций металлов помогает понять принципы и законы химии;
- Это активизирует познавательные процессы и развивает интерес к предмету;
- Знания химии помогают понимать состав и свойства окружающего нас мира;
- На основе изучения химических реакций металлов можно проанализировать экологические последствия промышленных процессов;
- изучение химических реакций металлов полезно для развития творческого подхода к решению задач;
Значение химии в 9 классе

В 9 классе изучение химии приобретает особое значение, поскольку ученики начинают погружаться в более сложные и глубокие аспекты этой науки. В этом возрасте они способны лучше понимать химические процессы и абстрактные понятия.
Одной из важнейших тем в химии 9 класса является изучение химических реакций металлов. Ученики знакомятся с основными металлами, их свойствами и способностью образовывать соединения с другими веществами. Это помогает им понять не только механизмы происходящих реакций, но и роль металлов в различных процессах, включая промышленность и технологии.
Изучение химических реакций металлов также помогает ученикам развивать важные навыки анализа и эмпирического мышления. Они учатся анализировать данные, проводить эксперименты и делать выводы на основе полученных результатов. Эти навыки не только пригодятся им в повседневной жизни, но и помогут им в дальнейшем обучении и будущей карьере.
Поскольку химические реакции металлов являются одной из основных тем химии в 9 классе, их изучение также помогает ученикам развивать что-то еще — навыки коммуникации и сотрудничества. Решение задач, проведение экспериментов и обсуждение результатов требует работать вместе в группе или команде. Это помогает учащимся улучшить навыки командной работы, лидерства и межличностного общения.
Основной блок уроков химии

Основной блок уроков химии в 9 классе посвящен изучению химических реакций металлов. Эта тема имеет большое значение, так как металлы являются одной из основных групп веществ, с которыми мы сталкиваемся в повседневной жизни. Целью изучения химических реакций металлов на уроках химии является освоение основных понятий и законов химии, а также развитие умений анализировать и объяснять химические явления.
На уроках химии в 9 классе ученики изучают различные типы реакций металлов, такие как реакции металлов с кислотами, реакции металлов с водой и реакции металлов с солями. Кроме того, в программе имеется изучение реакций образования оксидов и гидроксидов металлов. Ученики осваивают схему записи химических реакций в уравнениях и учатся определять стехиометрические коэффициенты.
При изучении химических реакций металлов особое внимание уделяется свойствам и особенностям разных металлов. Ученики изучают активность металлов, их реактивность и способы получения веществ на основе металлов. Знание этих свойств помогает предсказывать результаты химических реакций и применять полученные знания в реальной жизни, например, в технологических процессах или при выборе материалов для изготовления различных предметов.
В ходе уроков химии учителя применяют различные методы и формы работы, чтобы сделать уроки интересными и понятными для учеников. Это могут быть демонстрации опытов, лабораторные работы, задания для самостоятельной работы, презентации и даже практические занятия с использованием образцов металлов. Все это способствует более глубокому усвоению материала и формированию навыков рациональной и безопасной работы с химическими веществами.
Химические реакции металлов: теория и практика
Химические реакции металлов являются основной темой на уроках химии в 9 классе. Эти реакции обладают большим практическим значением и находят широкое применение в различных областях науки и промышленности.
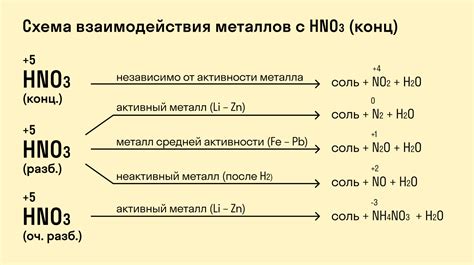
Основная теоретическая составляющая химических реакций металлов — это их способность вступать в реакции с кислотами. Металлы могут образовывать соли и выделяться водород. Например, реакцией цинка с соляной кислотой можно получить хлорид цинка и выделиться водород. Этот процесс можно представить в виде химического уравнения: Zn + 2HCl → ZnCl2 + H2.
Однако химические реакции металлов не ограничиваются только реакциями с кислотами. Они также могут вступать в реакции с кислотами солей, окислителями и растворителями. Например, железо способно реагировать с кислородом воздуха, образуя оксид железа. Это явление называется окислением металла. Химическую реакцию можно записать следующим образом: 4Fe + 3O2 → 2Fe2O3.
На практике изучение химических реакций металлов проводится с помощью различных лабораторных экспериментов. Ученики сами могут наблюдать, как металлы реагируют с различными веществами и оценивать результаты. Для этого используются различные методы, такие как наблюдение, взвешивание, измерение объема выделившегося газа и другие.
Изучение химических реакций металлов на уроках химии позволяет ученикам не только расширить свои знания о физико-химических свойствах металлов, но и развить навыки наблюдения, анализа экспериментальных данных и обобщения полученных результатов. Это поможет им лучше понять и применять принципы химических реакций в реальной жизни.
Примеры химических реакций металлов
Химические реакции металлов происходят при контакте с различными веществами, порой сопровождаясь изменением их внешнего вида и свойств. В результате таких реакций происходит образование новых веществ. Вот несколько примеров химических реакций металлов:
- Реакция цинка с кислотой: Цинк при взаимодействии с соляной кислотой образует хлорид цинка и выделяет водород. Уравнение реакции: Zn + 2HCl → ZnCl2 + H2.
- Реакция железа с кислородом: Железо при нагревании на воздухе окисляется до оксида железа(III). Уравнение реакции: 4Fe + 3O2 → 2Fe2O3.
- Реакция магния с хлором: Магний горит в хлоре с ярким пламенем, образуя хлорид магния. Уравнение реакции: 2Mg + Cl2 → 2MgCl2.
Описанные реакции металлов являются лишь некоторыми примерами. В химии известно множество других реакций, в которых металлы выступают активными участниками, образуя различные соединения и проявляя разнообразные свойства.
Вопрос-ответ

Какие металлы взаимодействуют с кислотами?
Многие металлы могут взаимодействовать с кислотами, образуя соли и выделяя водород. Например, цинк реагирует с соляной кислотой: Zn + 2HCl -> ZnCl2 + H2. Алюминий реагирует с серной кислотой: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2.
Что происходит при реакции металлов с кислотами?
При реакции металлов с кислотами образуются соли и выделяется водород. Соли, образовавшиеся в результате таких реакций, являются их продуктами, в то время как водород является отходом. Например, при реакции цинка с соляной кислотой образуется хлорид цинка (ZnCl2) и выделяется молекула водорода (H2).
Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами происходит окислительно-восстановительная реакция, в результате которой образуются соли и выделяется водород. Металлы отдают электроны, окисляются и становятся ионами, а водород принимает электроны, восстанавливается и образует молекулы. Например, при реакции цинка с соляной кислотой цинк отдает два электрона и окисляется до иона Zn2+, а молекулы кислоты принимают эти электроны и восстанавливаются до молекул водорода.
Какие металлы проявляют реакцию с водой?
Некоторые металлы могут реагировать с водой, образуя его гидроксиды и выделяя водород. Например, калий реагирует с водой: 2K + 2H2O -> 2KOH + H2. Литий также реагирует с водой: 2Li + 2H2O -> 2LiOH + H2.
Почему реакция металлов с кислотами сопровождается выделением водорода?
Реакция металлов с кислотами сопровождается выделением водорода, потому что водород является одним из продуктов этой реакции. В процессе взаимодействия металлов с кислотами металлы отдают электроны и окисляются, а кислоты принимают эти электроны и восстанавливаются. В результате водородные ионы объединяются с электронами и образуют молекулы водорода, которые выделяются в виде газа.
