Щелочноземельные металлы - это группа элементов таблицы периодов, которые находятся во второй группе и обладают свойствами, сходными с металлами, но отличными от щелочных металлов. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы имеют ряд особенностей и характеристик, которые делают их уникальными среди остальных элементов таблицы.
Из четырех недоступных щелочноземельных металлов, только бериллий и магний распространены в земной коре. Отличительной особенностью щелочноземельных металлов является их высокая электроотрицательность. Они также обладают химической активностью, которая растет с увеличением атомного номера.
Щелочноземельные металлы обладают хорошей термической и электрической проводимостью, что делает их полезными материалами для конструкций. Они также обладают высокой плотностью, температурой плавления и кипения, что позволяет им использоваться в различных промышленных процессах. Более того, эти элементы имеют малую величину ионных радиусов и способность образовывать стойкую оксидную пленку на поверхности, что делает их стойкими к окислению и коррозии.
Важно отметить, что щелочноземельные металлы обладают высокой химической реактивностью, что требует особой осторожности при обращении с ними. Они могут взаимодействовать с водой и кислородом, образуя щелочные оксиды и гидроксиды, а также выделяться в виде горючей водородной газа.
В целом, физические свойства щелочноземельных металлов делают их полезными для различных индустриальных и научных приложений. Магний применяется в авиационной и автомобильной промышленности, бериллий - в электронике и ядерных реакторах, а кальций - в производстве стекла и строительных материалов. Кроме того, элементы этой группы играют важную роль в жизнедеятельности организмов и имеют множество биологических функций.
Элементарные вещества и химические свойства
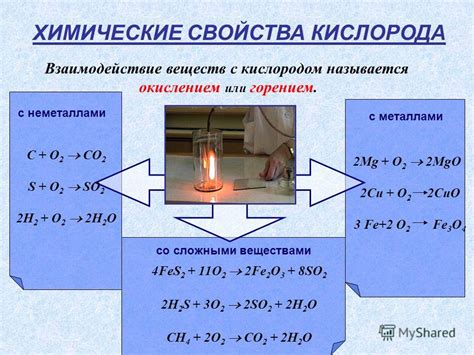
Элементарные вещества - это вещества, которые состоят из атомов одного вида химического элемента. Каждый химический элемент имеет свои уникальные свойства и химическую структуру. В таблице Менделеева известно более 100 элементов.
Химические свойства элементарных веществ определяют их взаимодействие с другими веществами при химических реакциях. К таким свойствам относятся: химическая активность, способность образовывать соединения с другими элементами, реакции окисления и восстановления.
Химическая активность - это способность элемента вступать в химические реакции при взаимодействии с другими веществами. Некоторые элементы имеют высокую активность и легко реагируют с веществами, а другие элементы имеют низкую активность и реагируют с трудом.
Способность элементов образовывать соединения определяется их электрохимическими свойствами. Некоторые элементы образуют ионы положительного заряда (катионы), другие элементы образуют ионы отрицательного заряда (анионы).
Реакции окисления и восстановления - это реакции, при которых происходит передача электронов между элементами. В таких реакциях один элемент окисляется, теряя электрон(ы), а другой элемент восстанавливается, получая электрон(ы).
Таблица Менделеева - это систематическое представление химических элементов по возрастанию их атомного номера, а также похожих химических свойств. В таблице указаны символы элементов, их атомные номера, относительные атомные массы и группы элементов с похожими свойствами.
Примеры элементарных веществ:
- Водород (H) - самый легкий химический элемент, обладает высокой химической активностью.
- Кислород (O) - газовый элемент, необходим для поддержания жизни на Земле и вступает в химические реакции с другими веществами.
- Углерод (C) - важный элемент для органической химии, образует основу органических соединений.
- Азот (N) - главный компонент воздуха, встречается в органических соединениях.
- Железо (Fe) - металл, используемый в различных отраслях промышленности и для производства стали.
Изучая элементарные вещества и их химические свойства, ученые получают новые знания о мире вокруг нас и разрабатывают новые материалы и технологии, которые применяются в различных отраслях науки и промышленности.
Физическая структура щелочноземельных металлов

Щелочноземельные металлы – это элементы, входящие во вторую группу периодической таблицы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают особыми физическими свойствами, в том числе и своей структурой.
Физическая структура щелочноземельных металлов характеризуется кристаллической решеткой. Кристаллическая решетка представляет собой упорядоченное расположение атомов в веществе. Бериллий имеет гексагональную кристаллическую решетку, в то время как все остальные щелочноземельные металлы обладают кубической решеткой.
В кристаллической решетке щелочноземельных металлов атомы расположены близко друг к другу и образуют компактную структуру. Это делает щелочноземельные металлы мягкими, легкими и пластичными. Они обладают хорошей пластичностью и способностью к обработке.
Кристаллическая структура щелочноземельных металлов также определяет их электронные свойства. Атомы этих металлов имеют слабо связанные валентные электроны, что делает их хорошими проводниками электричества и тепла. Благодаря этим свойствам щелочноземельные металлы широко применяются в электротехнике, производстве аккумуляторов и других устройствах.
Точка плавления и кипения

Щелочноземельные металлы обладают особыми физическими свойствами. Одно из важных свойств – это точка плавления и кипения данных металлов.
Точка плавления – это температура, при которой металл переходит из твердого состояния в жидкое. У щелочноземельных металлов точка плавления относительно низкая. Например, магний плавится при температуре около 650 °С, а бериллий – около 1280 °С.
Точка кипения – это температура, при которой жидкий металл превращается в пар. Для щелочноземельных металлов точка кипения также низкая. Например, барий кипит при температуре около 1870 °С, а радий – при температуре около 2022 °С.
Интересно отметить, что точка плавления и кипения щелочноземельных металлов возрастает с увеличением атомного номера элемента в периоде. Из этого следует, что барий имеет более высокую точку плавления и кипения, чем магний или бериллий.
Плотность и объемные свойства

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают высокой плотностью. Плотность щелочноземельных металлов увеличивается с увеличением атомного номера. Например, плотность бериллия составляет около 1,85 г/см³, а плотность радия может достигать 5 г/см³.
Плотность щелочноземельных металлов является свойством, характеризующим массу вещества, содержащегося в единице объема. Она определяется величиной и массой атомов вещества, а также их компактностью. Благодаря высокой плотности, щелочноземельные металлы обладают тяжелыми макроскопическими свойствами и сравнительно небольшим объемом по сравнению с другими элементами.
Одной из важных объемных характеристик щелочноземельных металлов является их атомный радиус. Атомный радиус определяет размер атома и его объем. Чем больше атомный радиус, тем больше объем атома. В серии щелочноземельных металлов атомный радиус увеличивается с увеличением атомного номера. Например, атомный радиус бериллия составляет около 0,11 нм, а атомный радиус радия - около 0,24 нм.
Твердость и механические свойства

Щелочноземельные металлы обладают высокой твердостью, что делает их прекрасными материалами для различных промышленных и научных приложений. Например, магний, один из щелочноземельных металлов, обладает твердостью 2,5 по шкале Мооса, что означает высокую устойчивость к царапинам и деформациям.
Одной из причин высокой твердости щелочноземельных металлов являются их межатомные связи. Атомы металлов в кристаллической решетке взаимодействуют через общие электронные облака, что придает материалу прочность и устойчивость.
Кроме того, механические свойства щелочноземельных металлов, такие как упругость и пластичность, делают их идеальными для использования в конструкционных материалах. Они легко поддаются обработке и изготовлению деталей различных форм и размеров.
Важно отметить, что упругие и пластические свойства щелочноземельных металлов зависят от структуры и композиции сплава. Например, добавление различных примесей может улучшить или ухудшить эти свойства.
Также, при увеличении содержания примесей в металлах твердость увеличивается, что может быть важно при выборе материала для определенного применения. Некоторые сплавы щелочноземельных металлов могут иметь твердость, сравнимую с некоторыми видами стали.
Электрические свойства

Щелочноземельные металлы обладают хорошей электропроводностью благодаря своей металлической структуре. Вещества, содержащие эти металлы, обладают способностью проводить электрический ток без значительного сопротивления.
Электрические свойства щелочноземельных металлов обусловлены наличием свободных электронов в их валентной оболочке. Эти электроны легко перемещаются по кристаллической решетке металла, что позволяет металлам быть хорошими проводниками электричества.
Удельная электрическая проводимость щелочноземельных металлов существенно выше, чем у неметаллических материалов или полупроводников. Они обладают низким электрическим сопротивлением, что делает их применимыми в различных электрических устройствах и схемах.
Однако при воздействии влаги на поверхность щелочноземельных металлов может образовываться оксидная пленка, которая препятствует электропроводности. Поэтому для обеспечения эффективной работы электрических устройств, содержащих щелочноземельные металлы, важно поддерживать их поверхность в чистом состоянии, либо использовать защитные покрытия.
Химическая активность и взаимодействие с другими веществами

Щелочноземельные металлы - это химически активные элементы, которые легко взаимодействуют с другими веществами.
Они обладают высокой реакционностью и способны образовывать стабильные соединения с различными элементами. Например, магний образует хлорид магния (MgCl2), бериллий - бериллиевую соль (BeCl2), а кальций - кальций хлорид (CaCl2).
Взаимодействие щелочноземельных металлов с кислородом также является важным аспектом их химической активности. Они легко окисляются воздухом, что приводит к образованию оксидов. Например, магний окисляется до оксида магния (MgO), а кальций - до оксида кальция (CaO).
Щелочноземельные металлы также реагируют с водой. Реактивность и скорость реакции зависят от конкретного металла. Например, бериллий реагирует медленно и практически не образует гидроксид, а магний образует гидроксид магния (Mg(OH)2).
Обращает на себя внимание также реакция щелочноземельных металлов с кислотами. Металлы различаются по степени реакционности. Например, магний реагирует с кислотами, что приводит к образованию солей и выделению водорода. Бериллий также реагирует с кислотами, но намного медленнее, а кальций образует хлорид кальция и водород.
Эти химические свойства щелочноземельных металлов являются фундаментальными и используются в различных областях науки и промышленности.
Вопрос-ответ

Каковы свойства щелочноземельных металлов?
Щелочноземельные металлы обладают рядом характерных физических свойств. Они являются мягкими, имеют низкую плотность, низкую температуру плавления и высокую электропроводность. Кроме того, они обладают ярким металлическим блеском и химической реактивностью.
Какие особенности имеют щелочноземельные металлы?
Особенности щелочноземельных металлов заключаются в их химической активности и способности образовывать ионы с двойным зарядом. Они также обладают низкой атомной массой и высокой электроотрицательностью, что делает их хорошими агентами для деактивации радиоактивных веществ.
Какова температура плавления щелочноземельных металлов?
Температура плавления щелочноземельных металлов варьирует в зависимости от конкретного элемента. Например, температура плавления магния составляет около 650 градусов Цельсия, а бария – около 725 градусов Цельсия. Общая тенденция заключается в том, что температура плавления увеличивается с увеличением атомной массы металла.
