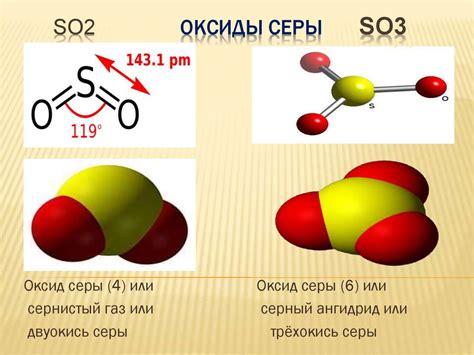
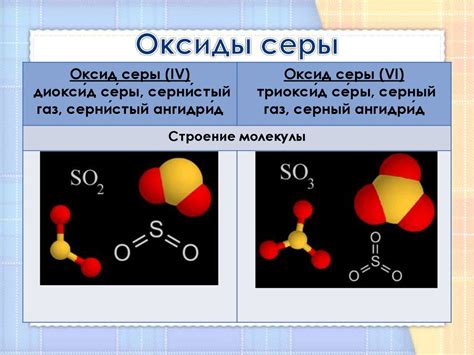
Оксид серы 4 (SO2) является одним из основных продуктов сгорания топлива, содержащего серу. Он обладает резким запахом и продуцируется различными промышленными процессами, включая нагревание руды и производство изделий из стали. Оксид серы 4 является безцветным газом, который при охлаждении и давлении может быть сжат в жидкое состояние.
Химические свойства оксида серы 4 с металлами обусловлены его способностью реагировать с кислотами и образовывать с ними соли. Такие реакции широко используются в химической промышленности для производства донашивных слоев оксида серы на поверхности металлических изделий, которые предоставляют дополнительную защиту от коррозии.
Оксид серы 4 также может быть использован в качестве окислителя в некоторых химических реакциях. Например, он может реагировать с металлом, образуя соответствующий металлический оксид и диоксид серы (SO2). Эта реакция может использоваться в процессе получения металлов из их руды или в производстве электродов для батарей.
Оксид серы 4 обладает также антисептическими свойствами и может быть использован в медицине для лечения определенных инфекций, таких как воспаление глаз или инфекции дыхательных путей. Однако, из-за его высокой токсичности, его использование ограничено и должно быть осторожным.
Таким образом, оксид серы 4 с металлами обладает разнообразными химическими свойствами и может находить применение в различных отраслях промышленности и медицины.
Свойства оксида серы 4 с металлами

Оксид серы 4 (СО2) – это бесцветный газ, образующийся при сгорании топлива с высоким содержанием серы. Как и другие оксиды серы, он обладает ядовитыми свойствами и негативно воздействует на окружающую среду и человека.
Свойства оксида серы 4 с металлами варьируются в зависимости от металлического элемента. Оксид серы 4 может проводиться и взаимодействовать с различными металлами, образуя соединения с разной степенью стабильности и химической активности.
Один из способов взаимодействия оксида серы 4 с металлами – это образование соединений с общей формулой МSO4. Такие соединения, называемые сульфатами металлов, являются солями серной кислоты и имеют важное применение в промышленности и сельском хозяйстве.
Оксид серы 4 может также действовать как окислитель при взаимодействии с некоторыми металлами. Например, снижаясь с 4-го к 2-му окислительному состоянию, он переходит из двуокиси серы в оксид серы 2. В этом случае, металлу отдается часть его электронов, и происходит окисление металла.
Некоторые металлы могут образовывать стойкие соединения с оксидом серы 4, такие как сульфиды металлов. Сульфиды обладают высокой степенью химической инертности и находят применение в качестве катализаторов, полупроводников, пигментов и других веществ.
Кислотное свойство оксида серы 4
Оксид серы 4 реагирует с водой, образуя серную кислоту – одну из важнейших сильных неорганических кислот. Реакция характеризуется выделением большого количества тепла и образованием пара серной кислоты.
С растворением оксида серы 4 в воде образуется сложная кислота, которая может агрессивно взаимодействовать с рядом веществ. Серная кислота может атаковать многие металлы, образуя с ними соли серной кислоты.
Реакция оксида серы 4 с основаниями протекает с выделением огромного количества тепла и образованием сульфатов.
Кислотное свойство оксида серы 4 проявляется также взаимодействием его с аммиачными растворами, при котором образуются сульфаты аммония, характеризующиеся сильной кислотностью.
Окислительное свойство
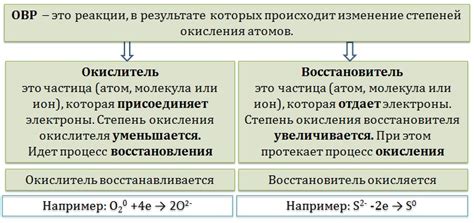
Оксид серы 4, или серный ангидрид, является сильным окислителем, что указывает на его высокую активность в химических реакциях. Способность оксида серы 4 окислять другие вещества связана с его электрохимическими свойствами.
Оксид серы 4 разлагается при нагревании, выделяя кислород, и может служить источником кислорода в окислительных реакциях. Этот процесс, известный как "декомпозиция", позволяет оксиду серы 4 цепной реакцией окислять металлы и неметаллы.
В окислительных реакциях оксид серы 4 может вступать в контакт с металлами и вызывать их окисление, при этом сам оксид берет на себя электроны. Поэтому оксид серы 4 считается окислителем.
Окислительное свойство оксида серы 4 можно использовать в различных промышленных процессах, например, при получении сероводорода из серы или для удаления серы из нефти и газа.
Химия реакции оксида серы

Оксид серы 4 (SO4) – это реактив, содержащий серу и кислород. Он получается при сжигании серы или при окислении сероводорода. Из-за своей активности оксид серы 4 является сильным окислителем и кислотой.
Реакция оксида серы с металлами может протекать по нескольким механизмам. Одним из них является окислительное действие оксида серы 4 на металлы. В этом случае оксид серы 4 отдаёт кислород, окисляясь до двухвалентной серы:
- 4SO42- + 6M → 2S2O3 + 6M2+ + 2O2
Реакции сильно взрывоопасны, так как сформировавшийся диоксид серы взаимодействует с влагой в воздухе, образуя серный ангидрид и тем самым инициирует взрывы.
Кроме того, оксид серы может взаимодействовать с металлами по другому механизму, называемому образованием соединений междувальентной серы. В результате этого процесса оксид серы 4 протекает в окисленном состоянии, а металлы окисляются до двухвалентного состояния. Пример такой реакции:
- SO4 + 2Fe → 3SO42- + 2Fe2+
Такие реакции особенно ярко выражены у меди, свинца и некоторых других металлов.
Реакция оксида серы с металлами

Оксид серы 4, также известный как сернистый ангидрид, является одним из основных оксидов серы. Он обладает формулой SO2. Этот соединение выражает свои химические свойства при взаимодействии с различными металлами.
Реакция оксида серы 4 с металлами может протекать следующими путями:
- Взаимодействие с щелочными металлами. При нагревании оксида серы 4 с щелочными металлами, такими как натрий или калий, образуется соединение металл-сернокислый ангидрид. Например, реакция натрия с оксидом серы 4 дает сернокислый натрий:
| Реакция | Уравнение |
|---|---|
| Соединение натрия с оксидом серы 4 | 2Na + SO2 → Na2SO3 |
- Взаимодействие с тяжелыми металлами. Оксид серы 4 может проявлять окислительные свойства при контакте с тяжелыми металлами, такими как свинец или медь. В результате реакции образуются соответствующие сернокислые соли:
- Соединение свинца с оксидом серы 4:
| Реакция | Уравнение |
|---|---|
| Соединение свинца с оксидом серы 4 | Pb + SO2 → PbSO3 |
- Соединение меди с оксидом серы 4:
| Реакция | Уравнение |
|---|---|
| Соединение меди с оксидом серы 4 | 2Cu + SO2 → CuSO3 |
Таким образом, реакция оксида серы 4 с металлами зависит от свойств конкретного металла и приводит к образованию соответствующих сернокислых солей.
Физические свойства оксида серы 4

Оксид серы 4, или SO4, является кристаллическим веществом, обладающим плотной структурой. Его молекулярная масса составляет около 64 г/моль, а его гулометрическая плотность - около 3 г/см3.
Оксид серы 4 имеет белый цвет и обладает высокой термической стабильностью. При нормальных условиях он не распадается и не испаряется. Однако при нагревании до высоких температур оксид серы 4 может претерпевать ряд химических реакций, в результате которых образуются другие оксиды серы.
Оксид серы 4 практически не растворим в воде, образуя лишь слабую кислоту. Несмотря на это, растворы оксида серы 4 обладают высокой концентрацией оксигена, что делает их эффективным окислителем. Они также являются сильно кислотной средой, способной разрушать металлы и органические материалы.
Оксид серы 4 обладает поверхностно-активными свойствами, благодаря которым он используется в процессах очистки газовых выбросов. Он способен адсорбировать различные соединения на своей поверхности, что позволяет удалять из отходящих газов опасные вещества и улучшать качество окружающей среды.
Оксид серы 4 в промышленности
Оксид серы 4, также известный как серный ангидрид, является одним из наиболее важных продуктов химической промышленности. Этот соединение образуется в результате сжигания серы или серосодержащих соединений в присутствии кислорода.
Оксид серы 4 применяется в производстве серной кислоты, которая в свою очередь широко используется в разных отраслях химической промышленности, включая производство удобрений, взрывчатых веществ, лекарственных препаратов и многое другое.
Также, оксид серы 4 применяется как антиоксидант, консервант и отбеливатель в пищевой промышленности и производстве бумаги и текстиля. Он обладает сильными окислительными свойствами, что позволяет эффективно удалять загрязнения и пятна.
Однако, следует отметить, что оксид серы 4 является токсичным веществом и может быть опасным для здоровья человека и окружающей среды. Поэтому его использование требует строгого контроля и соблюдения всех необходимых мер безопасности.
Использование оксида серы 4 в производстве

Оксид серы 4 является важным химическим соединением, которое активно используется в различных отраслях промышленности. Его применение связано с его химическими свойствами, в частности, с его реактивностью и способностью взаимодействовать с металлами.
Одним из основных способов использования оксида серы 4 в производстве является его применение в качестве катализатора при получении азотной кислоты. Оксид серы 4 ускоряет реакцию окисления аммиака, что позволяет увеличить производительность процесса и получить большее количество конечного продукта.
Также оксид серы 4 применяется как компонент в процессе производства сульфата алюминия. Он активно взаимодействует с алюминием, образуя сульфат серы и алюминия, который используется в самых различных промышленных отраслях, включая производство бумаги, текстиля, пищевых добавок и многих других.
В металлургической промышленности оксид серы 4 используется для удаления нечистот из стали и железа. Он реагирует с серой, содержащейся в металле, и образует газообразный оксид серы 6, который легко выводится из системы.
Также оксид серы 4 применяется в производстве резины, взрывчатых веществ, жидкостей для охлаждения двигателей и многих других продуктов. Его высокая реактивность и способность образовывать стабильные соединения с металлами делают его незаменимым во многих производственных цепочках.
Токсичность оксида серы 4

Оксид серы 4 — химическое вещество, которое относится к группе сернистых оксидов. Он представляет собой бесцветный газ с раздражающим запахом. Оксид серы 4 широко используется в промышленности и в научных исследованиях, однако его высокая токсичность требует специальных мер предосторожности при работе с ним.
Когда оксид серы 4 попадает в организм человека, он может вызывать различные проблемы со здоровьем. Вдыхание газа может вызвать першение в горле, кашель, одышку и проблемы с дыханием. Длительное воздействие оксида серы 4 может привести к серьезным заболеваниям дыхательной системы, таким как бронхит и пневмония.
Оксид серы 4 также может вызывать раздражение кожи и слизистых оболочек. При контакте с кожей он может вызвать покраснение, зуд, раздражение и ожоги. При попадании в глаза оксид серы 4 может вызвать раздражение, покраснение и даже временную потерю зрения.
Установлено, что оксид серы 4 является канцерогенным веществом и может вызывать рак легких у людей, которые длительное время находятся в контакте с ним. Поэтому крайне важно соблюдать все меры предосторожности при работе с этим веществом и использовать защитное снаряжение, такое как маска и перчатки.
Вопрос-ответ

Какие свойства оксида серы 4 проявляются при взаимодействии с металлами?
Оксид серы 4 обладает кислотными свойствами и может реагировать с металлами, образуя соответствующие соли серы 4. При этом металлы могут проявлять различную степень активности в реакции.
Какие металлы реагируют с оксидом серы 4?
С оксидом серы 4 реагируют различные металлы, включая цинк, железо, медь, алюминий и другие. Реакция может протекать с образованием соответствующих солей серы 4.
Каким образом происходит реакция оксида серы 4 с металлами?
Реакция оксида серы 4 с металлами происходит с выделением молекулы кислорода и образованием соли серы 4. Это типичная реакция оксида с образованием кислоты.
Какие свойства оксида серы 4 могут быть полезны при взаимодействии с металлами?
Оксид серы 4 обладает кислотными свойствами, что позволяет использовать его для получения различных солей серы 4. Такие соли могут иметь различные применения в химической промышленности и других областях.
Какие металлы реагируют с оксидом серы 4 быстрее?
С оксидом серы 4 реагируют быстрее более активные металлы, такие как цинк и алюминий. Они более легко отдают электроны и более активно вступают в реакцию с оксидом серы 4.
