Химические вещества часто вступают во взаимодействие с металлами, вызывая различные процессы и изменения в их структуре и свойствах. Причины такого взаимодействия могут быть разнообразными и зависят от самого металла и его свойств, а также от свойств химического вещества. Взаимодействие металлов с химическими веществами может приводить как к полезным, так и к негативным последствиям.
При взаимодействии химического вещества с металлом происходит образование новых соединений и изменение исходных свойств металла. Некоторые химические вещества могут вызывать окисление металла, что приводит к образованию покрытия окислов или солей на его поверхности. Это покрытие может быть полезным, например, в случае образования пассивной пленки, которая защищает металл от коррозии. Однако, в некоторых случаях покрытие может привести к ухудшению свойств металла или его разрушению.
Последствия взаимодействия химических веществ с металлами могут быть различными и зависят от конкретной системы "вещество-металл". В некоторых случаях взаимодействие может быть полезным и использоваться в промышленности для получения новых материалов с необходимыми свойствами. Однако, в других случаях взаимодействие может привести к нежелательным последствиям, таким как коррозия металла, ухудшение его механических свойств или даже отравление.
Химические вещества и металлы

Химические вещества и металлы взаимодействуют друг с другом в различных процессах, что может привести к различным последствиям. Взаимодействие металлов с химическими веществами может происходить в результате химических реакций, а также под действием различных физических факторов, таких как температура, давление и электромагнитные поля.
Металлы могут образовывать соединения с различными химическими элементами и соединениями. Например, реакция металла с кислотой может привести к образованию соли и выделению водорода. Это известно как замещение водорода или реакция металла с кислотой.
Взаимодействие металлов с кислотами может быть опасным, особенно если происходит с металлами, которые реагируют сильно и быстро, например, щелочные металлы, такие как натрий и калий. Такие реакции сопровождаются выделением большого количества газа и тепла, что может вызвать возгорание и даже взрывы.
Металлы также могут быть подвержены коррозии, то есть разрушению под действием химических веществ, таких как кислоты, соли и влага. Коррозия может происходить вследствие окисления металла, что приводит к образованию оксидов металла и ухудшению его физических свойств.
Иногда металлы могут использоваться в качестве катализаторов, то есть веществ, которые ускоряют химические реакции без изменения своей структуры. В таких случаях взаимодействие химических веществ с металлами может иметь положительные и полезные последствия.
Причины взаимодействия
Взаимодействие химических веществ с металлами происходит по различным причинам, которые определяют особенности этого процесса. Одной из причин является химическая реакция, возникающая между веществами и металлом. В ходе этой реакции происходит обмен электронами, что приводит к изменению состава и свойств исходных веществ и металла.
Другой причиной взаимодействия является наличие особых свойств металла, таких как его активность или способность к окислению. Некоторые металлы, например, алюминий или железо, имеют высокую активность и легко реагируют с различными веществами, включая кислоты или щелочи. Это объясняется их атомной структурой и внешним электронным слоем.
Кроме того, существует ряд физических причин, способствующих взаимодействию между веществами и металлами. Например, различия в растворимости веществ или их плотности могут приводить к образованию осадка или перемешиванию веществ. Эти физические свойства определяют механизм взаимодействия и характер изменений, происходящих в системе.
Взаимодействие химических веществ с металлами может иметь различные последствия. Оно может приводить к образованию новых веществ, которые имеют различные свойства и применяются в разных сферах, например, в промышленности или медицине. Также взаимодействие может приводить к разрушению металла или вещества, что может иметь негативные последствия, например, в виде коррозии или заржавления металла.
Электрохимические реакции

Электрохимические реакции представляют собой процессы, в которых происходит превращение химической энергии в электрическую и наоборот. В основе этих реакций лежит перенос электронов между реагирующими веществами.
Одним из типичных примеров электрохимических реакций является процесс окисления и восстановления металлов. При контакте металла с раствором его соли происходит перемещение электронов от металла к анионам соответствующей соли. Это приводит к тому, что металл окисляется, а его ионы снижаются до нулевого состояния. Таким образом, металл превращается в положительно заряженный ион и взаимодействует с анионом соли.
Электрохимические реакции имеют важное практическое применение. Например, они используются в гальванических элементах и аккумуляторах для создания и накопления электрической энергии. Эти устройства работают на основе принципа электрохимических реакций, которые происходят между двумя электродами. Одновременно происходит окисление одного электрода и восстановление другого, что создает разность потенциалов и порождает электрический ток.
Помимо этого, электрохимические реакции широко используются в процессах электролиза, при которых с помощью электрического тока происходит разложение веществ на ионы. Эта технология применяется для получения различных веществ, в том числе металлов, кислорода и хлора.
Коррозия металлов

Коррозия металлов – это процесс разрушения и повреждения поверхностей металлических материалов под воздействием органических или неорганических сред. Она возникает вследствие электрохимических реакций между металлом, окружающей средой и электролитом.
Процесс коррозии может привести к значительному ухудшению физических и механических свойств металла, а также вызвать его деформацию или полное разрушение. Коррозия является серьезной проблемой во многих отраслях промышленности, таких как строительство, автомобильное производство и нефтегазовая отрасль.
Основные причины коррозии металлов – это воздействие воды или влажной среды, а также наличие кислот, щелочей и солей. Вода, например, может ускорить процесс коррозии из-за наличия в ней растворенных солей и кислот. Влажная среда также способствует образованию коррозионных продуктов на поверхности металла.
Однако не все металлы одинаково подвержены коррозии. Некоторые металлы, такие как алюминий и цинк, обладают способностью к пассивации, что позволяет им сохранять свою поверхность в более защищенном состоянии. Для защиты металлических поверхностей от коррозии применяют различные методы, включая нанесение защитных покрытий, использование антикоррозийных добавок и применение специальных материалов с повышенной устойчивостью к коррозии.
Материалы для ионно-переходных процессов
Материалы, используемые для проведения ионно-переходных процессов, должны обладать определенными особенностями, обеспечивающими эффективность и стабильность переноса ионов. Одним из ключевых свойств таких материалов является их проводимость, которая позволяет электрическим токам проходить через них без большого сопротивления.
Однако, помимо хорошей проводимости, материалы для ионно-переходных процессов должны также обладать высокой химической стабильностью. Это необходимо для того, чтобы материалы не подвергались разрушительным химическим воздействиям, вызванным реакцией с ионами или другими химическими веществами.
Кроме того, материалы для ионно-переходных процессов должны быть долговечными и устойчивыми к агрессивной окружающей среде. Они должны сохранять свои свойства в течение длительного времени и не подвергаться коррозии или другим вредоносным процессам.
Интересным фактом является то, что некоторые материалы могут иметь разные свойства при взаимодействии с различными ионами. Например, некоторые вещества могут проявлять кислотные или основные свойства в зависимости от окружающей среды и вида ионов, с которыми они взаимодействуют.
Также материалы для ионно-переходных процессов могут быть представлены в различных формах, таких как порошки, гранулы, пленки и пр. Это позволяет использовать их в различных технологиях, включая электролиз, катализ и электрохимические процессы.
Свойства металлов при контакте с веществами
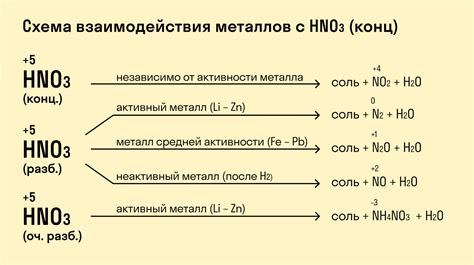
Реакция металлов с кислотами:
Металлы обладают различными свойствами при контакте с кислотами. Некоторые металлы, такие как цинк и алюминий, реагируют с кислотами, выделяя водород и образуя соли. Другие металлы, например железо и медь, не реагируют с кислотами при обычных условиях.
Взаимодействие металлов с щелочами:
Металлы могут образовывать с щелочами основания, которые в свою очередь обладают специфическими свойствами. Например, реакция натрия с водой приводит к образованию щелочи натрия и выделению водорода.
Влияние окружающей среды на свойства металлов:
Окружающая среда может оказывать существенное влияние на свойства металлов. Например, металлы могут коррозировать при длительном контакте с влажным воздухом или в присутствии определенных химических соединений. Коррозия может привести к постепенному разрушению металла.
Реакция металлов с газами:
Некоторые металлы могут сильно реагировать с газами, особенно при повышенных температурах. Например, магний сгорает на воздухе при длительном воздействии высоких температур.
Взаимодействие металлов с веществами:
Металлы могут взаимодействовать с различными веществами, включая органические соединения и неорганические вещества. Например, железо может образовывать сложные соединения с аммиаком, которые используются в промышленности и научных исследованиях.
Окисление и взаимодействие с кислородом
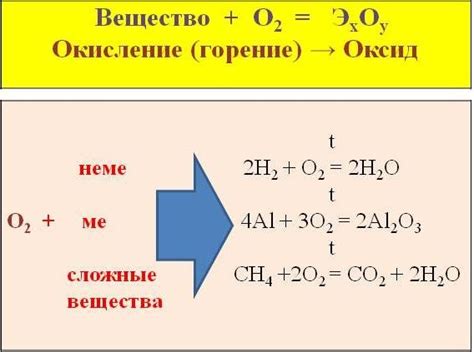
Окисление – один из типов взаимодействия химических веществ с металлами, при котором происходит процесс передачи электронов между веществами из-за химической реакции с кислородом. Кислород является одним из самых распространенных и активных химических элементов, поэтому его взаимодействие с металлами происходит широко и имеет разнообразные последствия.
Взаимодействие металлов с кислородом приводит к образованию оксидов металлов. Оксиды металлов могут иметь различные физические и химические свойства, что влияет на их применение в разных отраслях промышленности. Некоторые оксиды металлов являются прочными и устойчивыми веществами, а другие, например, оксиды железа, подвержены процессам коррозии.
Взаимодействие с кислородом одновременно может приводить к окислению металла и выделению энергии в виде тепла. Реакция окисления металла с кислородом может быть очень быстрой и интенсивной, особенно если металл находится в порошкообразном состоянии. Такие реакции называются горением металлов, которое может сопровождаться образованием яркого пламени и выделением большого количества тепла.
Окисление и взаимодействие металлов с кислородом играют важную роль в многих сферах нашей жизни. Например, окисление железа под действием кислорода приводит к образованию ржавчины, что является нежелательным процессом для многих металлических конструкций и поверхностей. Однако, некоторые металлы, такие как алюминий и нержавеющая сталь, образуют пассивную оксидную пленку на своей поверхности, которая предотвращает дальнейшее окисление и сохраняет их механические свойства.
Вопрос-ответ

Какие причины взаимодействия химических веществ с металлами?
Причинами взаимодействия химических веществ с металлами могут быть различные факторы. Одной из главных причин является химическая активность металлов. Металлы могут образовывать ионы, которые обладают зарядом и могут вступать в реакции с другими веществами. Также взаимодействие может быть связано с растворением металлов в реакции с кислотами или образованием оксидов и гидроксидов при взаимодействии с кислородом и водой.
Какие последствия может иметь взаимодействие химических веществ с металлами?
Взаимодействие химических веществ с металлами может иметь различные последствия. Одним из последствий является коррозия металлов. Коррозия – это процесс разрушения металла под воздействием химических реакций с окружающей средой. Взаимодействие металлов с кислотами может привести к выделению газов или образованию солей. Также, металлы могут вступать в реакции с другими веществами и изменять свои физические и химические свойства.
Какие металлы наиболее активно взаимодействуют с химическими веществами?
Наиболее активно с химическими веществами взаимодействуют щелочные и щелочноземельные металлы. К щелочным металлам относятся литий, натрий, калий, рубидий, цезий, франций. Они имеют высокую химическую активность и быстро реагируют с водой, кислородом и другими химическими веществами. Щелочноземельные металлы, такие как магний, кальций, стронций, барий и радий, также активно взаимодействуют с химическими веществами, но их активность не так высока, как у щелочных металлов.
