Реакции солей и металлов представляют собой процессы химического взаимодействия между веществами, которые происходят при определенных условиях. В химии существуют различные условия для проведения этих реакций, такие как температура, давление, концентрация реагентов и наличие катализаторов.
Одним из самых важных условий реакции солей и металлов является наличие активной поверхности металла. Для того чтобы произошла реакция между металлом и солью, соль должна быть в контакте с металлом и проникать в его поверхность. Это связано с тем, что реакция происходит на границе раздела веществ, и чем больше контактная поверхность между металлом и солью, тем интенсивнее будет происходить реакция.
Еще одним важным условием реакции солей и металлов является наличие влаги. Вода является важным реагентом во многих реакциях солей и металлов, поэтому без ее присутствия реакция может не произойти или протекать с низкой скоростью. При взаимодействии соли с влагой происходит растворение соли и образование ионов, а металл может реагировать с этими ионами, что приводит к образованию новых веществ.
Основные принципы химических реакций солей и металлов
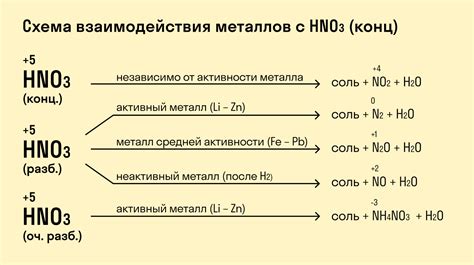
Химические реакции солей и металлов основываются на обмене ионами и образовании новых соединений. В химии ионы называются заряженными атомами или молекулами. В реакциях между солями и металлами происходит смена частей соединений, что приводит к образованию новых веществ и изменению характеристик исходных веществ.
Один из основных принципов реакций солей и металлов - образование отдельных ионов при растворении солей в воде. Это происходит из-за того, что вода является полярным соединением и образует анионы и катионы из ионов в растворе. Когда металлы вступают в реакцию с солями, ионы металлов заменяют ионы металлов в этой соли, образуя новое соединение.
Другим принципом реакций солей и металлов является активность металлов. Металлы имеют разную степень активности, что определяет их способность вступать в химические реакции с солями. Активные металлы, такие как натрий или калий, могут реагировать со многими солями и образовывать новые вещества. Менее активные металлы, такие как медь или свинец, могут реагировать только с определенными солями.
Также одним из важных принципов химических реакций солей и металлов является сохранение массы вещества. При ионном обмене и образовании новых соединений в реакциях солей и металлов масса исходных веществ должна быть равна массе образовавшихся веществ. Это также подтверждает закон сохранения массы, сформулированный Лавуазье.
В заключение, химические реакции солей и металлов основаны на обмене ионами, активности металлов и законе сохранения массы. Эти принципы позволяют предсказывать и объяснять результаты реакций между солями и металлами и используются в различных областях химии и промышленности.
Взаимодействие металлов с солями в растворе

Металлы могут реагировать с солями в растворе, образуя наблюдаемые изменения. В таких реакциях происходит обмен ионами между металлом и солью, что приводит к образованию новых соединений.
В целом, реакция металлов с солями может происходить по двум сценариям. Во-первых, металл может соревноваться с ионами соли за место в растворе. Если металл обладает более высокой активностью, чем ионы соли, то он вытесняет их, образуя свои собственные ионы в растворе. В результате этой реакции наблюдается выпадение осадка или изменение цвета раствора.
Во-вторых, металл может реагировать с ионами соли, образуя новое соединение. В этом случае обмен ионами приводит к образованию новой соли, которая может быть растворимой или нерастворимой. Нерастворимые соли выпадают в виде осадка, тогда как растворимые соли остаются в растворе без образования осадка.
Реакция металлов с солями в растворе может быть использована для определения активности металлов или для получения нерастворимых солей. Например, реакция железа с соляной кислотой может использоваться для определения активности железа, так как при этой реакции возникает характерный зеленый осадок. Кроме того, реакция цинка с хлоридом свинца может использоваться для получения хлорида цинка в виде нерастворимого осадка, который можно использовать в химических процессах.
Термическое разложение солей металлов

Термическое разложение солей металлов представляет собой процесс распада соединений металлов на металлический оксид и свободный кислород путем нагревания. Данная реакция может происходить как в присутствии кислорода, так и в его отсутствие.
Для проведения термического разложения солей металлов необходимо применять достаточно высокую температуру. Точная температура зависит от конкретного соединения и может быть определена экспериментально. Однако, обычно разложение начинается при температуре около 1000°C.
Соли металлов, которые подвергаются разложению при нагревании, включают в себя различные типы соединений, такие как нитраты, карбонаты, гидроксиды и другие. Например, нагревание нитрата свинца (Pb(NO3)2) приводит к его разложению на оксид свинца (PbO), который остается в твердом состоянии, и диоксид азота (NO2), который выделяется в виде газа.
Термическое разложение солей металлов может использоваться в различных областях. Например, данная реакция является важным этапом в процессе получения металлов из их руд или источников. Кроме того, термическое разложение солей металлов может использоваться в производстве керамики и стекла, а также в других промышленных процессах.
Взаимодействие солей с металлами в твердом состоянии
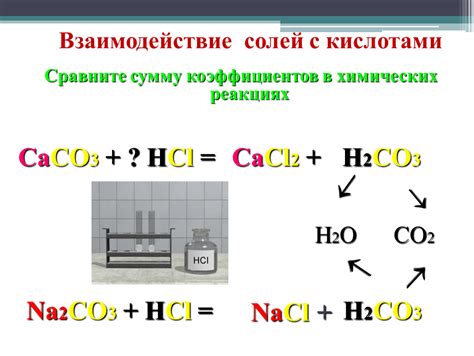
Взаимодействие солей с металлами в твердом состоянии является одной из важнейших химических реакций. В результате таких реакций образуются новые соединения, которые могут иметь различные свойства и применения в разных областях.
Соли - это химические соединения, которые образуются в результате реакции кислоты с основанием. Они могут быть представлены в виде кристаллического твердого вещества. Металлы, в свою очередь, обладают специфическими физическими и химическими свойствами и могут быть представлены в различных формах - как проводники электричества и тепла, как строительные материалы и др.
Взаимодействие солей с металлами в твердом состоянии может протекать по разным сценариям. Оно может привести к образованию нового твердого вещества - металлического солида, которое может обладать новыми свойствами и использоваться в различных областях промышленности. Например, металлический солид может использоваться для создания новых материалов с уникальными физическими и химическими свойствами.
Взаимодействие солей с металлами в твердом состоянии может также приводить к образованию различных соединений, которые могут иметь значительное значение в науке и технологии. Некоторые из таких соединений могут обладать магнитными свойствами, быть полупроводниками или иметь высокую прочность и стойкость к воздействию внешних факторов.
В целом, взаимодействие солей с металлами в твердом состоянии представляет собой интересное исследовательское направление, которое позволяет получить новые соединения с уникальными свойствами. Это направление имеет большое значение в различных областях науки и технологии и может привести к разработке новых материалов и технических решений, которые будут применяться в жизни людей.
Образование растворимых и нерастворимых солей

При взаимодействии солей с водой происходит образование растворимых и нерастворимых соединений. Растворимые соли характеризуются способностью полностью растворяться в воде, образуя прозрачные растворы.
Растворимость солей зависит от ряда факторов, таких как температура, концентрация и наличие других веществ. Некоторые соли, такие как хлорид натрия и сульфат аммония, образуют растворы, которые могут быть использованы в различных промышленных и химических процессах.
Однако некоторые соли оказываются нерастворимыми в воде и образуют осадки. Это может быть вызвано низкой растворимостью соли или наличием других веществ, которые могут реагировать с соединением и образовывать нерастворимые комплексы. Примерами нерастворимых солей являются оксиды и гидроксиды металлов, такие как гидроксид железа и оксид меди.
Образование растворимых и нерастворимых солей имеет важное практическое применение. Растворимые соли используются в процессах, связанных с очисткой воды, производством лекарственных препаратов и удобрений. Нерастворимые соли могут использоваться в различных химических реакциях, в том числе в процессе образования кристаллов, при окрашивании и в электрохимических процессах.
Влияние температуры на реакцию между солями и металлами

Температура играет важную роль в реакциях между солями и металлами. При повышении температуры, скорость реакции может увеличиваться или уменьшаться в зависимости от конкретных условий.
Повышение температуры может, например, увеличить скорость реакции, так как это приводит к увеличению энергии частиц и обеспечивает большую активность молекул и ионов. При этом, активация ионов в растворе также может быть способствована повышению температуры.
Однако в некоторых случаях повышение температуры может замедлить реакцию между солями и металлами. Это может происходить, когда при повышении температуры образуются стабильные соединения, например, оксиды металлов, которые становятся защитными пленками на поверхности металла, препятствуя дальнейшей реакции.
Иными словами, температура может оказывать как положительное, так и отрицательное влияние на реакцию между солями и металлами. Исследование данного влияния является важным в контексте разработки и оптимизации промышленных процессов, включающих взаимодействие солей и металлов при различных температурах.
В целом, для более полного понимания влияния температуры на реакции между солями и металлами, требуется дальнейшее исследование и эксперименты. Многие факторы могут влиять на результат реакции, поэтому необходимо рассматривать каждый конкретный случай индивидуально, учитывая специфические условия и химические взаимодействия.
Роль pH среды в условиях реакции солей и металлов

pH среды играет важную роль в условиях реакции солей и металлов, поскольку определяет степень их растворимости и возможность протекания химических превращений.
В кислой среде, при наличии H+ инициируется реакция растворения солей и металлов с образованием ионов металла и соответствующих солей. Например, в непрерывном присутствии свободных H+ и Cl-, соль меди превращается в ионное соединение меди и хлора, что обуславливается кислотными свойствами среды.
В щелочной среде, при наличии OH-, реакции солей и металлов протекают иначе. Степень растворимости солей увеличивается, так как ионы металла эффективно сорбируются к гидроксидным ионам. Таким образом, металлы могут выделяться элементарным состоянием.
Реакция растворения солей и металлов может происходить под влиянием нейтральной среды. В этом случае, ионы металла и анионы соли находятся в равновесии и могут представлять стабильные соединения.
Наличие определенного pH среды является необходимым условием для реакции солей и металлов. Изменение pH среды может значительно изменить кинетику и характер химической реакции, что в свою очередь, может найти применение в различных промышленных и химических процессах.
Вопрос-ответ

Какие условия влияют на реакцию солей и металлов?
Реакция солей и металлов зависит от множества условий, таких как температура, наличие катализаторов, концентрация реагентов и pH среды.
Какие металлы реагируют с солями?
Некоторые металлы могут реагировать с солями, образуя новые соединения. Например, цинк может реагировать с хлоридами, образуя хлорид цинка, алюминий может реагировать с сульфатами, образуя сульфат алюминия.
Какие реакции происходят при взаимодействии солей и металлов?
При взаимодействии солей и металлов могут происходить различные химические реакции, такие как образование осадков, газов или новых соединений. Например, реакция между медным сульфатом и железом приводит к образованию меди и сульфата железа.
