Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются очень активными элементами, благодаря которым реакция с водородом может быть довольно интенсивной и интересной. Эти металлы имеют одну электронную оболочку, что делает их неподвижными и стабильными.
Когда щелочные металлы вступают в реакцию с водородом, происходит образование щелочных гидридов. Гидриды этих металлов обладают высоким порядком кристаллизации и обычно образуют кубическую решетку. Они также являются твердыми веществами с высоким температурным плавлением.
Под действием водорода щелочные металлы могут вступать в реакцию различной степени интенсивности. Например, литий и натрий являются более реакционноспособными, чем калий, рубидий и цезий. Когда металл вступает в реакцию с водородом, образуется водородный газ и соответствующий гидрид.
Например, реакция лития с водородом выглядит следующим образом:
2Li + H2 → 2LiH
Эта реакция происходит при нагревании. Натрий образует натриевый гидрид (NaH), калий – калиевый гидрид (KH), рубидий – рубидиевый гидрид (RbH), а цезий – цезиевый гидрид (CsH).
Реакция щелочных металлов с водородом имеет важное применение в различных областях, включая производство металлов, электролиз и химическую промышленность. Подобные реакции позволяют получать гидриды, которые могут быть использованы для производства множества химических соединений и материалов.
Общие сведения о реакции щелочных металлов с водородом

Реакция щелочных металлов с водородом является одним из характерных примеров химической реакции, происходящей между неметаллом и металлом. В данной реакции неметалл водород образует соединение с металлом щелочного ряда, образуя гидрид металла.
Щелочные металлы, такие как литий, натрий, калий, реагируют с водородом при нормальных условиях, образуя соответствующие гидриды. Эта реакция является экзотермической и сопровождается выделением тепла.
Обычно реакция щелочных металлов с водородом протекает быстро и с большой интенсивностью. В процессе реакции металл щелочного ряда отдает свой электрон водороду, образуя ион металла и ион водорода. Данная реакция является примером окислительно-восстановительного процесса, где щелочный металл действует как окислитель, а водород - как восстановитель.
- Литий реагирует с водородом, образуя литийгидрид (LiH), который обладает сильными восстановительными свойствами.
- Натрий реагирует с водородом, образуя натрийгидрид (NaH), который широко используется в химической промышленности.
- Калий реагирует с водородом, образуя калийгидрид (KH), который обладает схожими свойствами с натрийгидридом.
Таким образом, реакция щелочных металлов с водородом является важным химическим процессом, который находит применение в различных областях, включая каталитические процессы и производство химических соединений.
Важность реакции щелочных металлов с водородом
Реакция всех щелочных металлов с водородом имеет большое значение для изучения химических процессов и развития промышленности. Она позволяет получить важные химические соединения, которые широко применяются в различных отраслях науки и промышленности.
Одним из результатов реакции щелочных металлов с водородом является образование гидридов щелочных металлов. Эти вещества обладают высокой химической активностью и могут использоваться в качестве сильных восстановителей и катализаторов в различных процессах. Также гидриды щелочных металлов находят применение при производстве металлов и сплавов.
Реакция щелочных металлов с водородом также позволяет получать важные вещества для производства электролитических источников тока. Например, при реакции лития с водородом образуется литиевый гидрид, который используется в качестве материала для создания литиевых ионных аккумуляторов.
Более того, реакция щелочных металлов с водородом имеет важное значение в аналитической химии. Она используется для определения концентрации водорода в различных веществах, а также для идентификации и количественного анализа щелочных металлов. Такие исследования необходимы для контроля качества сырья и продуктов, а также для разработки новых материалов и технологий.
Таким образом, реакция щелочных металлов с водородом играет важную роль в различных научных и технических областях. Она позволяет получать новые соединения, разрабатывать новые технологии и улучшать существующие процессы. Изучение этой реакции способствует развитию химии, физики и других наук, а также созданию новых материалов и технологий, что имеет большое значение для прогресса общества.
Физические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них есть множество характерных физических свойств, которые отличают их от других элементов.
Во-первых, щелочные металлы обладают металлическим блеском. Их поверхность обычно имеет серебристый цвет. На воздухе они быстро окисляются и покрываются слоем оксида или пасмурности.
Во-вторых, щелочные металлы обладают низкой плотностью. Например, литий является самым легким металлом, а калий – одним из самых легких в группе. Низкая плотность обусловлена большими межатомными расстояниями и большими атомными радиусами у этих элементов.
Также щелочные металлы обладают низкой температурой плавления и кипения. Наиболее низким температурным показателем в этой группе обладает литий – его температура плавления составляет всего около 180 градусов Цельсия.
Кроме того, щелочные металлы хорошо проводят тепло и электричество. Они являются металлами-проводниками. Их электропроводность основана на свободной подвижности электронов в их кристаллической решетке.
Наконец, щелочные металлы очень мягкие и хорошо обрабатываемые металлы. Например, натрий так мягок, что его можно резать ножом. Мягкость обусловлена слабостью межатомных сил и слабостью связи между атомами в металле.
Химические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают уникальными химическими свойствами, которые делают их одними из самых активных элементов в периодической системе.
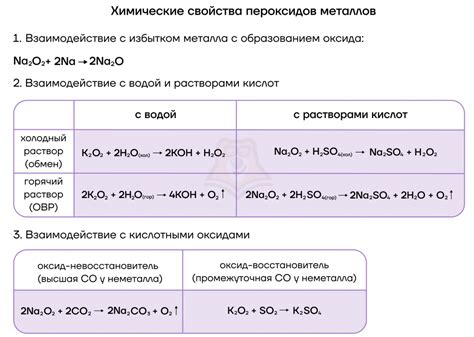
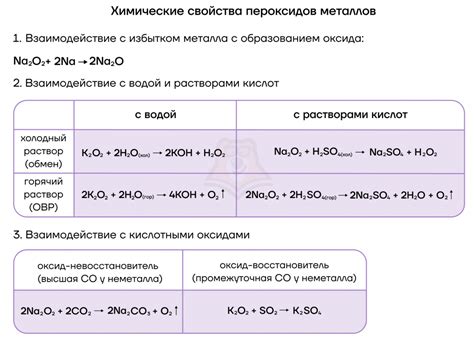
Во-первых, щелочные металлы легко реагируют с кислородом из воздуха, образуя оксиды. Эта реакция происходит быстро и сопровождается выделением тепла. Например, натрий реагирует с кислородом из воздуха, образуя оксид натрия (Na2O):
4Na + O2 → 2Na2O
Во-вторых, щелочные металлы очень реактивны с водой. При контакте с водой они образуют гидроксиды и выделяются водород. Правда, разные металлы реагируют с водой по-разному. Литий, наиболее легкий из щелочных металлов, реагирует менее активно, при этом выделяется меньше водорода, чем при реакции других металлов. Рубидий и цезий, наиболее тяжелые из щелочных металлов, реагируют очень быстро, причем реакция может быть настолько сильной, что может вызвать вспышку и взрыв.
Кроме того, щелочные металлы обладают высокой электроотрицательностью, что позволяет им активно взаимодействовать с другими элементами. Например, щелочные металлы реагируют с хлором, образуя соль. Реакции этих металлов с другими элементами и соединениями широко используются в химической промышленности и в процессах синтеза различных веществ.
Таблица 1: Реакция щелочных металлов с водородом
| Металл | Реакция с водородом |
|---|---|
| Литий | 2Li + H2 → 2LiH |
| Натрий | 2Na + H2 → 2NaH |
| Калий | 2K + H2 → 2KH |
| Рубидий | 2Rb + H2 → 2RbH |
| Цезий | 2Cs + H2 → 2CsH |
Химические свойства щелочных металлов делают их полезными и в то же время опасными веществами. Они могут быть использованы в различных индустриальных процессах, в производстве керамики, стекла, щелочи, а также в батареях и аккумуляторах. Однако, из-за своей высокой реактивности, щелочные металлы могут быть опасными в хранении и использовании. Поэтому при работе с ними необходимо соблюдать все меры безопасности.
Процессы реакции щелочных металлов с водородом
При контакте щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, с водородом происходят различные химические процессы.
В результате реакции лития с водородом образуется литийгидрид. Это белый кристаллический порошок, который является хорошим взрывчатым веществом и используется в пиротехнике.
Натрий, взаимодействуя с водородом, образует натрийгидрид. Этот соединение является бесцветным кристаллическим веществом, которое используется в качестве катализатора в различных химических процессах.
Реакция калия с водородом протекает с образованием калия гидрида. Калийгидрид мелкого размера имеет фиолетовый цвет и применяется в фотографии в качестве фотоинтенсификатора.
Рубидий и цезий, вступая в реакцию с водородом, образуют соответствующие гидриды – рубидийгидрид и цезийгидрид. Эти соединения применяются в производстве фотоэлементов и теплоэлектрических преобразователей.
Выделение водорода из реакций щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают высокой реакционной способностью и температурой плавления, что делает их идеальными для выделения водорода из различных соединений. Реакции этих металлов с водородом являются одними из наиболее распространенных способов получения этого газа.
Взаимодействие щелочных металлов с водородом протекает с высокой интенсивностью. При взаимодействии с водородом щелочные металлы образуют гидриды, которые являются стабильными и обладают низкими температурами плавления и кипения. Гидриды щелочных металлов могут быть использованы в различных отраслях промышленности, включая производство энергии, химическую промышленность и синтез различных соединений.
Процесс выделения водорода из реакции щелочных металлов с водородом описывается следующим образом: при нагревании металла с водородом образуется гидрид металла и энергия. Далее, гидрид металла подвергается реакции диссоциации, в результате которой образуется водород и металл в исходной форме. Реакция происходит в присутствии катализаторов, что позволяет увеличить скорость процесса и повысить его эффективность.
Выделение водорода из реакций щелочных металлов является важным шагом в процессе его получения. Этот газ имеет широкий спектр применений, начиная от использования в реакциях синтеза и оборудовании для водородной энергетики до использования в пищевой и фармацевтической промышленности. Развитие и улучшение способов выделения водорода из реакций щелочных металлов имеет большое значение для развития современных технологий и обеспечения энергетической безопасности.
Применение реакции щелочных металлов с водородом

Реакция щелочных металлов с водородом (H₂) является одним из важных процессов в химической промышленности и научных исследованиях. Эта реакция представляет собой достаточно активное взаимодействие, которое результативно используется в различных сферах.
1. Производство водорода
Взаимодействие щелочных металлов с водородом позволяет получить водород, который является одним из важнейших промышленных химических веществ. Водород используется в производстве аммиака, метанола, водородной перекиси и других продуктов.
2. Энергетика
Реакция щелочных металлов с водородом имеет важное значение в области энергетических технологий. Водород является перспективным источником чистой энергии. Водородные топливные элементы на основе реакции с щелочными металлами обладают высокой энергетической плотностью и широкими возможностями применения в подводной и авиационной технике, а также в электромобилях.
3. Химическая синтез
Реакция щелочных металлов с водородом используется в химической синтезе для получения различных органических и неорганических соединений. Например, с помощью этой реакции можно получить луг, металлогидриды, гидриды некоторых элементов и многое другое. Также она часто применяется для превращения одного вещества в другое и модификации различных химических соединений.
4. Анализ и исследования
Реакция щелочных металлов с водородом широко применяется в аналитической химии для определения различных веществ и исследования их свойств. Взаимодействие щелочных металлов с водородом позволяет проводить качественные и количественные скачковые исследования, а также использовать эту реакцию в процессе разработки новых методов анализа и синтеза.
Безопасность и ограничения использования реакции

Реакция щелочных металлов с водородом является очень опасной и требует соблюдения особых мер безопасности. Во-первых, при начале реакции может происходить выброс водорода под давлением, что может вызвать возгорание или взрыв. Поэтому реакцию следует проводить в специально оборудованных лабораториях или под контролем специалистов.
Ограничения использования реакции связаны с высокой активностью щелочных металлов и их способностью к реакции с водородом. Данный процесс может быть использован только в строго контролируемых условиях и для специфических целей. Например, реакция щелочных металлов с водородом может использоваться в процессе производства пищевых консервантов или в качестве источника водорода для промышленных нужд.
Также следует отметить, что при работе с щелочными металлами необходимо использовать защитные средства, такие как перчатки, защитные очки и специальную одежду. Кроме того, реакцию следует проводить в хорошо проветриваемых помещениях, чтобы избежать скопления опасных паров.
В целом, реакция всех щелочных металлов с водородом является сложным и опасным процессом, который требует специальных условий и навыков для проведения. Подходящие меры безопасности должны быть соблюдены, чтобы избежать возможных потерь и опасных ситуаций.
Вопрос-ответ

Какие вещества образуются при реакции щелочных металлов с водородом?
При реакции щелочных металлов с водородом образуются гидриды щелочных металлов. Например, реакция натрия с водородом приводит к образованию натриевого гидрида (NaH).
Можно ли использовать щелочные металлы в качестве источника водорода?
Да, щелочные металлы могут использоваться в качестве источника водорода. Реакция щелочных металлов с водой или паром ведет к образованию водорода. Это свойство может быть полезно в различных технологических процессах и водородной энергетике.
Что происходит сщелочными металлами при контакте с водородом?
При контакте щелочных металлов с водородом происходит реакция, в результате которой образуются гидриды щелочных металлов. Эта реакция является экзотермической и сопровождается выделением тепла.
Какова реакция лития с водородом?
При реакции лития с водородом образуется литиевый гидрид (LiH). Уравнение реакции можно записать следующим образом: 2Li + H2 = 2LiH.
