Химические свойства элементов в значительной мере определяются электроотрицательностью вещества. Электроотрицательность – это способность атома притягивать к себе общую электронную пару в химической связи. Чем выше электроотрицательность элемента, тем сильнее он привлекает электроны к себе и тем более активными являются его химические свойства.
Фактор электроотрицательности влияет на ряд химических свойств элементов, таких, как атомный радиус, ионный радиус, энергия ионизации (энергия, необходимая для отщепления одного электрона от атома), электроаффинность (способность атома притягивать дополнительные электроны), а также активность элемента в химических реакциях.
Например, элементы с высокой электроотрицательностью, такие как кислород, азот, фтор, обладают высокой электроаффинностью и, следовательно, легко принимают дополнительные электроны. Это даёт им возможность образовывать стабильные отрицательно заряженные ионы в химических реакциях и быть активными окислителями. С другой стороны, элементы с низкой электроотрицательностью, такие как натрий, калий, обладают низкой электроаффинностью и легко отдают свои электроны, образуя положительно заряженные ионы, что является характерной чертой металлов.
Таким образом, электроотрицательность является важным химическим показателем, определяющим химические свойства элементов и позволяющим понять, каким образом элементы взаимодействуют друг с другом в химических реакциях.
Влияние электроотрицательности на химические свойства

Электроотрицательность - это характеристика атома, отражающая его способность притягивать электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны к себе и выражает свою невосприимчивость к электронам другого атома.
Интересно, что электроотрицательность элементов находится в тесной связи с их химическими свойствами. Сильно электроотрицательные элементы, такие как кислород, фтор, хлор, обычно обладают высокой атомной энергией и стремятся к образованию ковалентных связей с другими элементами.
При образовании связи между атомами с различными электроотрицательностями происходит перераспределение электронной плотности в молекуле. Атом с более высокой электроотрицательностью привлекает электроны к себе сильнее, что делает его отрицательно заряженным, а атом с более низкой электроотрицательностью становится положительно заряженным.
Такая разница в электроотрицательности ведет к развитию полярной связи, которая характеризуется неравномерным распределением зарядов внутри молекулы. Это влияет на ряд химических свойств веществ, таких как температура кипения, температура плавления, растворимость и электрохимическая активность.
Таким образом, электроотрицательность элементов играет важную роль в определении их химических свойств. Она влияет на тип и силу химических связей, а также на реакционную способность элементов. Знание электроотрицательности позволяет предсказывать химическое поведение веществ и осознавать взаимосвязь между химическими свойствами элементов.
Электроотрицательность как характеристика элементов
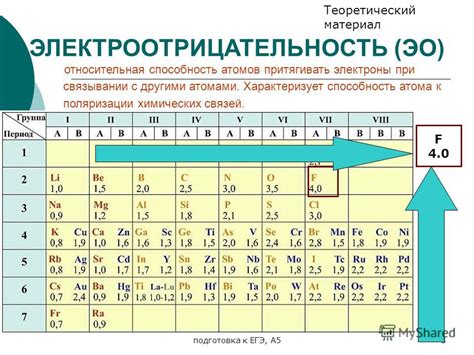
Электроотрицательность – это важная характеристика элементов, которая описывает их способность притягивать электроны в химических связях. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны. Эта величина оказывает влияние на многие химические свойства элементов и их соединений.
Электроотрицательность определяется по шкале, разработанной Линусом Полингом. Наиболее электроотрицательными элементами являются флуор, кислород и хлор, а наименее электроотрицательными – франций и цезий. Электроотрицательность может использоваться для предсказания свойств химических соединений, например, силы и типа химической связи.
Из электроотрицательности элементов можно сделать вывод о том, как они взаимодействуют в химических реакциях. При образовании ионной связи один элемент, обладающий большей электроотрицательностью, отдает электроны другому элементу. В ковалентной связи электроотрицательность элементов определяет, как сильно они притягивают общие электроны и как распределяется заряд в молекуле.
Электроотрицательность играет важную роль в химической реактивности элементов. Например, элементы с высокой электроотрицательностью, такие как кислород и флуор, обладают сильной способностью окислять другие вещества. Элементы с низкой электроотрицательностью, например, алкалии и некоторые металлы, имеют тенденцию быть окисляемыми.
Таким образом, электроотрицательность является полезной характеристикой элементов, которая помогает понять и предсказать их химические свойства и взаимодействия. Она играет важную роль в объяснении многих явлений и процессов в химии.
Связь электроотрицательности с электронной структурой
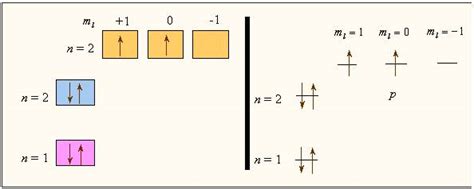
Электроотрицательность химического элемента является важной характеристикой, связанной с его электронной структурой. Электронная структура определяет, какие электроны расположены на энергетических уровнях атома и как они связаны между собой. Атомы с различными электронными структурами могут иметь различную электроотрицательность.
Электроотрицательность элемента зависит от его способности притягивать электроны в химической связи. Атомы с более высокой электроотрицательностью имеют большую способность притягивать электроны и образовывать сильные химические связи. Это связано с их электронной структурой, так как они имеют большее количество электронов в более энергетически высоких орбиталях, что создает сильные притягивающие силы.
С другой стороны, атомы с более низкой электроотрицательностью имеют меньшую способность притягивать электроны и образовывать слабые химические связи. Это связано с их электронной структурой, где орбитали заполнены более плотно и меньшее количество электронов находится на более энергетически высоких уровнях.
Таким образом, электроотрицательность элемента связана с его электронной структурой и может быть использована для предсказания его химических свойств. Элементы с большей электроотрицательностью будут иметь больше возможностей образовывать сильные химические связи и могут проявлять свойства, такие как высокая реактивность или способность образовывать ионные соединения. В то же время, элементы с низкой электроотрицательностью будут иметь более слабые химические связи и могут проявлять свойства, такие как малая реактивность или способность образовывать ковалентные соединения.
Взаимодействие элементов с разными электроотрицательностями
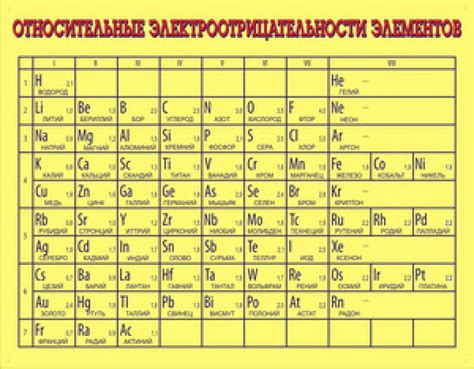
Электроотрицательность элемента является важной характеристикой, которая определяет его способность привлекать электроны при образовании химических связей. Взаимодействие элементов с разными электроотрицательностями играет ключевую роль в формировании различных химических соединений и реакций.
Когда элемент с более высокой электроотрицательностью встречается с элементом с более низкой электроотрицательностью, происходит передача электронов от менее электроотрицательного элемента к более электроотрицательному. Это приводит к образованию ионов и образцов ионной связи. В таких соединениях один элемент оказывается заряженным положительно (катион), а другой - заряженным отрицательно (анион).
Взаимодействие элементов с разными электроотрицательностями также может приводить к образованию ковалентной связи. В этом случае происходит обмен электронами между атомами. Атом более электроотрицательного элемента привлекает электроны сильнее и удерживает их ближе к себе, что создает полярность молекулы. Этот тип связи часто встречается в органических соединениях и является основой для образования сложных молекулярных структур.
Взаимодействие элементов с разными электроотрицательностями также влияет на реакционную способность веществ. Сильные различия в электроотрицательности могут приводить к более активной реакции, включая окислительно-восстановительные реакции, реакции замещения и реакции с образованием новых химических связей.
Следует отметить, что взаимодействие элементов с разными электроотрицательностями может быть разным в различных условиях и с разными соединениями. Некоторые сочетания элементов могут образовывать стабильные и стойкие соединения, тогда как другие могут быть нестабильными и склонны к реакциям.
Вопрос-ответ

Как связана электроотрицательность и химические свойства элементов?
Электроотрицательность - это способность атома притягивать электроны к себе в химической связи. Она влияет на химические свойства элементов, так как определяет их способность образовывать ионы, претерпевать химические реакции и вступать в химические соединения. Элементы с высокой электроотрицательностью имеют большую способность притягивать электроны и образовывать отрицательные ионы, в то время как элементы с низкой электроотрицательностью имеют меньшую способность к этому. Это также влияет на различные химические свойства, включая активность элементов и их способность образовывать разнообразные химические соединения.
Какую роль играет электроотрицательность в связывании атомов?
Электроотрицательность играет важную роль в связывании атомов. Высокая электроотрицательность атома означает, что он имеет большую способность притягивать электроны к себе, что делает его электронегативным. Низкая электроотрицательность, напротив, означает меньшую способность атома притягивать электроны и делает его электроположительным. Когда атомы с разной электроотрицательностью образуют химическую связь, электроотрицательный атом притягивает электроны сильнее и становится отрицательно заряженным, а атом с меньшей электроотрицательностью становится положительно заряженным. Это создает полярную связь, что влияет на химические свойства соединения.
