Взаимодействие металла с кислотой – один из основных процессов в химии, который имеет множество практических применений. Это взаимодействие обусловлено специфическими свойствами как металлов, так и кислот.
Металлы обладают высокой электропроводностью и могут участвовать в электрохимических реакциях. Они обычно выступают в роли восстановителей во взаимодействии с кислотами. Кислоты, в свою очередь, содержат ион водорода (H+), который при контакте с поверхностью металла может отдавать электроны и образовывать соответствующие ионы металла. Таким образом, при взаимодействии металла с кислотой происходит электрохимическая реакция, результатом которой являются образование новых веществ и выделение газа.
Примерами взаимодействия металлов с кислотами являются различные химические реакции, такие как растворение металла в кислоте или замещение металла в кислоте. Например, при растворении цинка в соляной кислоте образуется ион цинка (Zn2+) и выделяется водородный газ. В таких реакциях металл может стать более активным веществом, а кислота может изменить свои свойства или степень окисления.
Важно отметить, что взаимодействие металла с кислотой может быть опасным и требует соблюдения мер безопасности. При проведении таких экспериментов необходимо использовать защитные средства, такие как перчатки и защитные очки, а также проводить их лишь в специально оборудованных помещениях.
Таким образом, взаимодействие металла с кислотой – это сложный химический процесс, который имеет большое значение в научных и практических целях. Изучение этого взаимодействия позволяет более глубоко понять химические свойства металлов и кислот, а также разрабатывать новые реакции и материалы для различных отраслей промышленности.
Металл и кислота: взаимодействие и его особенности
Взаимодействие металла с кислотой представляет собой химический процесс, при котором происходит реакция между металлом и кислотой. Этот процесс может иметь различные характеристики, зависящие от типа металла и кислоты, и может сопровождаться выделением газа, тепла или образованием осадка.
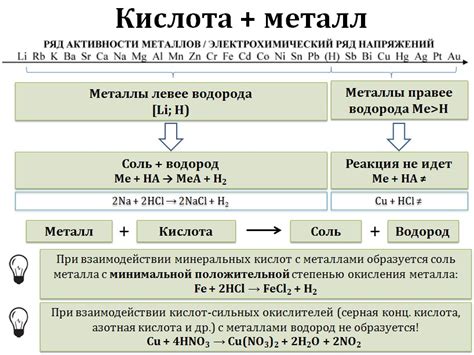
Основным результатом взаимодействия металла и кислоты является образование соли и выделение водорода. Кислота взаимодействует с поверхностью металла, разрушая его и образуя ионы металла и ионы водорода. Изменение степени активности металла может привести к более или менее интенсивному взаимодействию с кислотой.
Одной из особенностей взаимодействия металла с кислотой является возможность выбора подходящей пары металла и кислоты для достижения необходимого результата. Например, для быстрого выделения водорода можно использовать активный металл, такой как цинк или алюминий, с концентрированной кислотой, такой как серная или азотная. При этом процесс будет происходить более интенсивно и с большим выделением газа.
Следует также отметить, что взаимодействие металла с кислотой может протекать спонтанно, но также может быть ускорено при использовании катализатора. Катализатор представляет собой вещество, которое повышает скорость реакции без самостоятельного участия в ней. Это может быть металл, окись металла или другое вещество.
Взаимодействие металла с кислотой имеет широкий спектр применения в промышленности и научных исследованиях. Например, процесс гальванического покрытия металлом основан на взаимодействии металла с кислотой. Кроме того, этот процесс может служить основой для создания аналитических методов определения содержания металла в растворе.
Основная суть процесса

Взаимодействие металла с кислотой является химическим процессом, который протекает в результате образования электрохимической ячейки между металлом и раствором кислоты. Основной суть данного процесса заключается в том, что кислота, обладающая высокой степенью активности, образует ионизированные частицы в растворе, которые, в свою очередь, вступают в реакцию с металлом. В результате реакции образуются новые соединения, включая соли металла и водород.
Металл может вступать в реакцию с кислотами различной концентрации и активности. Некоторые металлы, такие как цинк или алюминий, активно реагируют с кислородной кислотой, например серной, образуя соли и выделяя водородный газ. Другие металлы, включая железо или медь, могут реагировать с разными типами кислот, образуя различные соли и выделяя водород, но реакция может протекать медленнее и с меньшей степенью активности.
Важно учитывать, что взаимодействие металла с кислотой может протекать не только с образованием солей и выделением водорода, но также может сопровождаться растворением металла в кислоте или образованием окислов и газов. Кроме того, реактивность металла и кислоты может зависеть от температуры, концентрации и других условий, что влияет на скорость и характер процесса.
Примеры взаимодействия

1. Реакция меди с серной кислотой:
Медь (Cu) с раствором серной кислоты (H2SO4) образует соединение меди(II) сульфата (CuSO4) и выделяет газовый продукт - диоксид серы (SO2). Реакция протекает следующим образом:
Cu + H2SO4 -> CuSO4 + SO2 + H2O
2. Реакция железа с соляной кислотой:
Железо (Fe) при взаимодействии с соляной кислотой (HCl) образует соль железа(III) хлорида (FeCl3) и освобождает водород (H2). Уравнение реакции имеет вид:
Fe + 3HCl -> FeCl3 + 3H2
3. Реакция цинка с азотной кислотой:
Цинк (Zn) с азотной кислотой (HNO3) образует соль цинка(II) нитрат (Zn(NO3)2) и выделяет оксид азота (NO). Уравнение реакции можно записать следующим образом:
Zn + 2HNO3 -> Zn(NO3)2 + H2O + NO
4. Реакция алюминия с соляной кислотой:
Алюминий (Al) при взаимодействии с соляной кислотой (HCl) образует соль алюминия(III) хлорида (AlCl3) и выделяет водород (H2). Уравнение реакции выглядит следующим образом:
2Al + 6HCl -> 2AlCl3 + 3H2
5. Реакция свинца с серной кислотой:
Свинец (Pb) при взаимодействии с серной кислотой (H2SO4) образует соль свинца(II) сульфата (PbSO4) и выделяет сернистый газ (SO2). Уравнение реакции имеет вид:
Pb + H2SO4 -> PbSO4 + SO2 + H2O
Особенности реакции

Взаимодействие металла с кислотой является реакцией окисления-восстановления, так как на протяжении процесса происходит передача электронов от металла кислоте. Кислота действует как окислитель, тогда как металл выступает в роли восстановителя.
От типа кислоты зависит скорость реакции. Например, сильные минеральные кислоты, такие как серная или хлорная кислоты, обладают достаточно высокой активностью и быстро реагируют с металлами. Однако, реакция с более слабыми кислотами, такими как уксусная или лимонная кислоты, может происходить медленнее.
Основной продукт реакции металла с кислотой - соль металла и вода. Однако, иногда также могут образовываться дополнительные побочные продукты, например, газы или осадки. Некоторые металлы, такие как цинк или алюминий, способны образовывать защитную пленку на своей поверхности, которая не позволяет дальнейшему разрушению металла в результате действия кислоты.
Взаимодействие металла с кислотой может протекать с различной интенсивностью в зависимости от концентрации кислоты, температуры и других условий. Для контроля данного процесса часто применяют специальные методы, такие как потенциостатическая истинная поляризация или волтамперометрия, которые позволяют определить скорость реакции и другие кинетические параметры.
Влияние параметров на результат
Результат взаимодействия металла с кислотой может зависеть от нескольких параметров. Первым параметром, на который следует обратить внимание, является концентрация кислоты. Чем выше концентрация кислоты, тем более интенсивно будет происходить реакция с металлом.
Другим важным параметром является температура среды. При повышении температуры увеличивается скорость реакции металла с кислотой. Однако следует помнить о том, что при слишком высоких температурах металл может раствориться полностью и реакция может стать необратимой.
Также влияние на результат оказывает поверхность металла. Чем больше площадь поверхности, на которой происходит реакция, тем более интенсивно она протекает. Поэтому металлы, имеющие пористую или шероховатую поверхность, более склонны к реакции с кислотой.
Наконец, важным параметром является время взаимодействия. Длительность контакта металла с кислотой определяет степень реакции и ее результат. Чем дольше металл находится в кислотной среде, тем больше вещества перейдет в раствор и тем интенсивнее будет происходить реакция.
Вопрос-ответ

Какие металлы не реагируют с кислотами?
Некоторые металлы, такие как золото и платина, не реагируют с кислотами. Это связано с их низкой химической активностью и стабильностью.
Какие металлы реагируют с кислотами?
Многие металлы, такие как железо, цинк, алюминий, реагируют с кислотами. Например, железо может реагировать с соляной кислотой, цинк - с серной кислотой, алюминий - с соляной и серной кислотами.
Как происходит реакция металла с кислотой?
При реакции металла с кислотой происходит образование соли и выделение водорода. Например, в результате реакции цинка с соляной кислотой образуется хлорид цинка и выделяется водородный газ.
