Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) являются химической группой элементов в периодической таблице. Они обладают рядом уникальных химических свойств, которые объясняются их электронной структурой и взаимосвязью между атомами.
Одним из основных химических свойств щелочных металлов является их активность. Все щелочные металлы очень реактивны и быстро взаимодействуют с водой и кислородом. Это связано с тем, что щелочные металлы имеют один электрон в внешней электронной оболочке, что делает их весьма нестабильными. Для достижения более стабильного состояния, щелочные металлы предпочитают отдавать этот электрон, образуя положительный ион, и вступая в реакции с другими веществами.
Другим важным химическим свойством щелочных металлов является их способность растворяться в воде и образовывать гидроксиды. Более высокий элемент в группе, тем более велика его реактивность и способность образовывать гидроксиды сильной щелочности. Например, натрий образует гидроксид натрия (NaOH), также известный как содовая щелочь, которая используется в множестве промышленных и бытовых целях.
Взаимосвязь между химическими свойствами щелочных металлов объясняется их электронной структурой и способностью образовывать ионы. Они обладают сильной аффинностью к электронам и вступают в реакции, чтобы достичь более стабильного состояния. Изучение щелочных металлов позволяет глубже понять химические процессы, происходящие в природе и в химической промышленности.
Физические свойства щелочных металлов

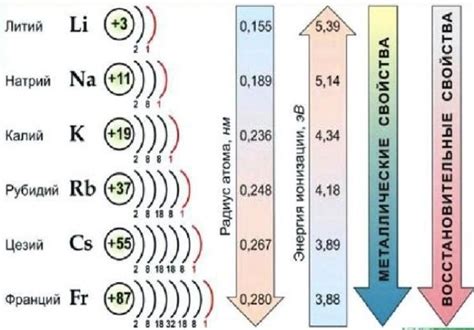
Щелочные металлы - это группа химических элементов, которые находятся в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Физические свойства этих металлов включают низкую плотность, мягкость, низкую температуру плавления и высокую электропроводность.
Все щелочные металлы имеют низкую плотность, что означает, что они легкие и могут плавать на поверхности воды. Например, литий имеет плотность около 0,53 г/см³, тогда как плотность алюминия - около 2,7 г/см³. Это делает щелочные металлы очень удобными для использования в различных областях, включая простую тару и легкие конструкции.
Щелочные металлы также характеризуются мягкостью. Например, кусок калия легко можно разрезать ножом. Мягкость способствует легкому формированию и использованию этих металлов в различных приложениях, таких как изготовление аккумуляторов и процессов, связанных с электрохимией.
Температура плавления щелочных металлов также относительно низкая. Например, температура плавления калия составляет всего 63,3 °C. Это означает, что при достижении этой температуры калий станет жидким состоянием. Это важное свойство щелочных металлов используется в различных процессах и технологиях, включая металлургию и высокотемпературную электронику.
Еще одно физическое свойство, характерное для щелочных металлов, - высокая электропроводность. Они являются хорошими проводниками электричества, что делает их важными компонентами в различных электрических системах и устройствах, таких как провода и электролитические растворы.
Электрохимическая активность щелочных металлов

Щелочные металлы относятся к самым электрохимически активным элементам в периодической системе. Это означает, что они легко отдавают электроны и образуют положительные ионы.
Наибольшую активность проявляют литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Эти металлы обладают очень низкой энергией ионизации, что делает их исключительно реактивными.
Электрохимическая активность щелочных металлов проявляется в их способности образовывать связи с другими элементами путем передачи электронов. Они могут легко образовывать ионы положительного заряда, которые притягивают к себе электроны от других элементов.
Щелочные металлы реагируют с различными веществами, включая воду, кислород, халогены и некоторые неорганические соединения. Они образуют гидроксиды, оксиды, пероксиды, галогениды и другие соединения, которые обладают разнообразными свойствами и широко используются в различных областях промышленности и научных исследований.
На основе электрохимической активности щелочных металлов можно проводить различные эксперименты и реакции. Например, можно наблюдать реакцию щелочного металла с кислородом, при которой образуется оксид металла и выделяется большое количество энергии.
Также электрохимическая активность щелочных металлов является основой для работы щелочных элементов в различных электрохимических процессах, таких как батарейки, электролиз, гальваническая коррозия и другие.
Реакция щелочных металлов с водой

Реакция щелочных металлов с водой является одним из характерных химических свойств этой группы элементов. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, реагируют с водой, образуя гидроксид и выделяя водород.
Реакция начинается с образования щелочных металлов и гидроксида металла. При этом восемь электронов переносятся с одного атома щелочного металла на восемь молекул воды, что приводит к образованию ионов гидроксидов и ионов гидрония.
Реактивность щелочных металлов с водой возрастает при увеличении атомного номера в периоде. Например, литий реагирует слабо с водой, образуя гидроксид и выделяя небольшое количество водорода, в то время как цезий реагирует с водой с большой интенсивностью, образуя гидроксид и выделяя значительное количество водорода и тепла.
Реакция щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Это объясняет появление яркого пламени при соприкосновении щелочных металлов с водой.
Реакция щелочных металлов с водой имеет широкое применение в химической промышленности и лабораторных условиях. Например, гидроксиды щелочных металлов используются в процессах очистки воды и производства мыла. А выделение водорода может быть использовано в качестве источника энергии или применено в химических реакциях.
Взаимодействие щелочных металлов с кислородом

Щелочные металлы - это группа элементов, которые активно реагируют с кислородом, образуя оксиды. Оксиды щелочных металлов часто обладают основными свойствами и образуют щелочные растворы при взаимодействии с водой.
При реакции щелочных металлов с кислородом может происходить образование различных оксидов. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O), который является основной составной частью поваренной соли, кровоочистителей и стекла. Калий, в свою очередь, образует оксид калия (K2O), который используется в производстве шампуней, красителей и дрожжей.
Взаимодействие щелочных металлов с кислородом происходит при высоких температурах, например, при горении или прямой реакции с кислородом. При этом образуются оксидные соединения, которые имеют важное промышленное применение и широко используются в различных отраслях науки и промышленности.
Образование щелочных металловых оксидов и пероксидов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют оксиды и пероксиды в процессе взаимодействия с кислородом. Оксиды щелочных металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода.
Образование оксидов сопровождается окислением металла. Например, реакция натрия с кислородом приводит к образованию оксида натрия (Na2O), а реакция калия - к образованию оксида калия (K2O).
Пероксиды щелочных металлов, в отличие от оксидов, содержат два атома кислорода в молекуле. Например, пероксид натрия (Na2O2) образуется при взаимодействии натрия с избыточным количеством кислорода. Пероксиды обладают более высокой окислительной активностью по сравнению с оксидами и могут использоваться в качестве мощных окислителей.
Образование щелочных металловых оксидов и пероксидов связано с высокой реакционной способностью этих металлов и их способностью взаимодействовать с кислородом. Эти соединения находят широкое применение в различных областях химии, включая промышленность, электроэнергетику и медицину.
Роторные выколки щелочных металлов: структура и химия
Роторные выколки щелочных металлов – это специальные структуры, которые обладают высокой устойчивостью и активностью в химических реакциях. Они представляют собой молекулы, в которых центральный атом щелочного металла окружен равномерно распределенными ортоэлементами. Такая структура обеспечивает устойчивость роторной выколки и позволяет создавать высокие энергетические барьеры в химических реакциях.
Химия роторных выколок щелочных металлов основана на специфической реактивности и сильноэкзотермических эффектах, которые происходят при взаимодействии с другими веществами. Основной химической особенностью роторных выколок щелочных металлов является их способность к разрыву химических связей и образованию новых связей с другими атомами или молекулами.
Процессы, в которых участвуют роторные выколки щелочных металлов, включают в себя реакции диссоциации, сопровождающиеся образованием ионов, а также реакции обмена лигандов, при которых происходит замена одних атомов или молекул на другие. Благодаря своей высокой активности и специфичности, роторные выколки щелочных металлов широко используются в химической и фармацевтической промышленности, а также в катализе и синтезе органических соединений.
В заключение, структура и химия роторных выколок щелочных металлов предоставляют нам возможность использовать эти уникальные структуры в различных химических процессах. Их специфические свойства позволяют нам управлять химическими реакциями и создавать новые функциональные материалы с улучшенными свойствами.
Специфика солей щелочных металлов
Соли щелочных металлов, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают рядом специфических химических свойств. Их соли обычно хорошо растворимы в воде и образуют щелочные растворы с высоким pH. Эти металлы имеют низкую электроотрицательность и, соответственно, низкую энергию ионизации, что обуславливает их высокую реактивность.
Соли щелочных металлов широко применяются в различных областях:
- Большое количество щелочных металлов используется в производстве стекла, поскольку они способны снижать температуру плавления и улучшать свойства стекла.
- Некоторые соли щелочных металлов, особенно натрия и калия, используются в фармацевтической и пищевой промышленности в качестве регуляторов кислотности и пищевых добавок.
- Соли щелочных металлов также находят применение в производстве мыла, моющих средств и синтетических детергентов, благодаря своей способности образовывать щелочные растворы, которые эффективно очищают поверхности от жиров и грязи.
Одной из особенностей солей щелочных металлов является их способность образовывать двойные соли с другими соединениями. Это свойство может быть использовано в различных процессах, таких как синтез химических соединений или отделение и очистка веществ.
Важно отметить, что многие соли щелочных металлов являются токсичными, поэтому необходимо соблюдать соответствующие меры предосторожности при работе с ними.
Вопрос-ответ

Какие существуют щелочные металлы?
Щелочные металлы включают себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Почему щелочные металлы реактивны?
Щелочные металлы реактивны из-за своей низкой ионизационной энергии и высокой реакционной способности. Их внешний электронный слой содержит только один электрон, что делает их непостоянными и стремящимися к нейтрализации. Как результат, они легко реагируют со многими другими веществами, включая воду и кислород.
