Металлы и соли – две основные группы веществ, которые встречаются в нашей жизни повсюду. Соли, как химические соединения между металлами и неметаллами, обладают такими свойствами, как растворимость, кристаллическая структура и способность проводить электрический ток в растворе.
Между солью и металлом может происходить реакция, в результате которой образуются новые вещества. Некоторые металлы могут активно взаимодействовать с солью, образуя осадок или растворяясь в ней. Такие реакции могут быть использованы для получения металлов или их соединений, а также в промышленности и научных исследованиях.
Примером металла, который реагирует с солью, может служить алюминий. Положительный ионы алюминия могут взаимодействовать с отрицательными ионами соли, образуя осадок или растворяясь в растворе. Например, при реакции алюминия с хлористым натрием (NaCl), получается осадок хлорида алюминия (AlCl3), который обычно имеет белый цвет.
Другим примером такого взаимодействия является реакция цинка с серной кислотой (H2SO4). В результате реакции образуется гидроксид цинка (Zn(OH)2) и сероводород (H2S). Эти новые вещества имеют другие свойства и могут быть использованы в различных областях, включая промышленность и медицину.
Реакции металлов и солей: важная информация

Металлы и соли могут взаимодействовать химически и образовывать различные соединения. Эти реакции имеют важное значение в различных областях, включая промышленность и химическую науку. Понимание этих реакций помогает улучшить процессы производства и разработать новые материалы.
Взаимодействие металлов и солей может происходить по разным механизмам. Некоторые металлы могут просто растворяться в солевых растворах, образуя ионы. Например, медь может растворяться в серной кислоте и образовывать сульфат меди.
Другие металлы могут реагировать более активно с солями, образуя осадки. Например, реакция между цинком и хлоридом свинца приводит к образованию осадка белого цвета, который представляет собой хлорид цинка.
Кроме того, некоторые металлы могут вытеснять другие металлы из их солей. Например, активный металл алюминий может вытеснить менее активный металл медь из ее сульфата. В результате получается осадок меди и раствор алюминиевого сульфата.
Реакции металлов с солями также могут иметь практическое применение. Например, электролиз медного сульфата позволяет получить медь в чистом виде. Эта реакция используется в процессах производства и переработки металлов.
Металлы, которые участвуют в реакции с солью
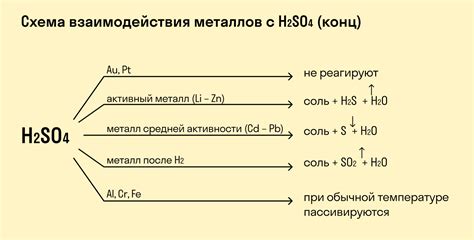
Металлы являются активными элементами, которые легко реагируют с солью, образуя различные соединения. Эти реакции являются основой многих химических процессов и имеют широкий спектр применений в промышленности и научных исследованиях.
Одним из наиболее известных примеров реакции металла с солью является реакция железа с хлоридом железа. При этой реакции образуется сульфат железа и хлороводород. Это является одним из примеров окислительно-восстановительной реакции, где железо окисляется и хлорид железа восстанавливается.
Другим примером реакции металла с солью является реакция цинка с серной кислотой. В результате этой реакции образуется сульфат цинка и выделяется водород. Реакция между металлом и солью протекает с выделением тепла и изменением состояния вещества.
Металлы, которые образуют соединения с солью, включают алюминий, медь, свинец, никель, кобальт и другие. Эти металлы могут образовывать различные типы соединений с солью, включая хлориды, сульфаты, нитраты и прочие.
Важно отметить, что реакция металла с солью может быть нежелательной в некоторых случаях, так как может приводить к образованию нестабильных или токсичных соединений. Поэтому при использовании металлов в промышленных процессах или лабораторных исследованиях необходимо учитывать и контролировать реакцию с солью.
Практические примеры реакций металлов с солью

Железо и серная кислота: При реакции железа с серной кислотой образуется сульфат железа(II) и выделяется сернистый газ. Этот процесс часто используется в лаборатории для получения сернистого газа и соли железа.
Медь и азотная кислота: При реакции меди с азотной кислотой образуется нитрат меди(II) и выделяется образующийся оксид азота(II). Эту реакцию можно использовать для получения нитратов меди(II) и азота.
Цинк и хлорид меди: При реакции цинка с хлоридом меди образуется хлорид цинка и цинковая медь. Эта реакция может применяться для получения цинковых соединений и меди.
Алюминий и хлорид кобальта: При реакции алюминия с хлоридом кобальта образуется хлорид алюминия и кобальт. Эту реакцию можно использовать для получения хлорида алюминия и кобальта.
Свинец и нитрат серебра: При реакции свинца с нитратом серебра образуется осадок серебра и нитрат свинца. Этот процесс может применяться для получения серебра и нитрата свинца.
Образование осадка при реакции металлов и солей

Реакция металлов с солями может привести к образованию осадка. Осадок представляет собой мелкие твердые частицы, которые выпадают из раствора и оседают на дне. Образование осадка является результатом реакции между ионами металла и ионами соли.
Одним из примеров такой реакции является взаимодействие металла меди с раствором серной кислоты. При этом в растворе образуется сульфат меди, который является солью, и оседает медь в виде осадка. Эта реакция происходит в два этапа: окисление меди до ионов меди(II), а затем соединение ионов меди(II) с ионами сульфата и образование осадка.
Кроме меди, реакцию с солью могут проводить и другие металлы, такие как железо, цинк, свинец и др. Например, реакция цинка с раствором хлорида свинца приводит к образованию осадка хлорида цинка. В этой реакции ионы цинка соединяются с ионами хлорида и формируют твердые частицы, которые выделяются в виде осадка.
Образование осадка при реакции металлов и солей имеет широкий спектр применений в различных областях, начиная от химических исследований до производства материалов. Это явление позволяет проводить реакции металлов и солей с целью получения определенных продуктов или очистки растворов от нежелательных примесей.
Процессы окисления и восстановления в реакции металлов и солей
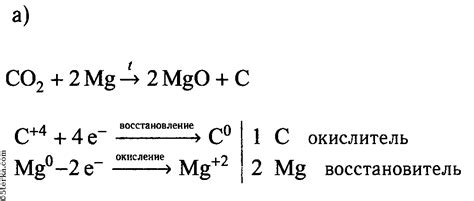
Реакция металлов с солями основана на процессах окисления и восстановления, которые происходят в ходе химической реакции между металлом и солью. Во время реакции металл отдает электроны, при этом происходит его окисление, а соль восстанавливается. Этот процесс является основой для ряда промышленных процессов и имеет важное значение в химии.
В результате окисления металлов и восстановления солей могут образовываться различные продукты. Например, при реакции цинка с серной кислотой образуется сульфат цинка и выделяется водород. Это происходит потому, что цинк (Zn) окисляется до иона Zn2+ и отдает два электрона, а серная кислота (H2SO4) восстанавливается до серы и водорода. Эта реакция является типичным примером реакции металла с солью.
Окисление и восстановление в реакции металла и соли происходит благодаря разнице в электроотрицательности между главной группой металла и солей. Металлы, обладающие более низкой электроотрицательностью, имеют склонность отдавать электроны и окисляться. Соли, с другой стороны, восстанавливаются в процессе реакции, принимая электроны от металла. Этот процесс может происходить быстро или медленно в зависимости от условий реакции.
- Процессы окисления и восстановления в реакции металлов и солей имеют широкий спектр применений. Например, они могут использоваться в электролизе для разделения веществ на ионы, а также для производства электрической энергии в батареях и аккумуляторах.
- При взаимодействии металла с солью образуется гораздо более стабильное соединение, чем просто соли или металла отдельно. Это объясняется тем, что окисление и восстановление организуются в реакции, что приводит к образованию более устойчивых ионных комплексов.
- Окисление и восстановление металлов и солей также имеют важное значение в биохимии, где эти процессы являются ключевыми для многих жизненно важных реакций. Например, в биологических системах окисление и восстановление играют роль в процессах дыхания и фотосинтеза.
Таким образом, процессы окисления и восстановления в реакции металлов и солей являются фундаментальными явлениями в химии и имеют широкий спектр применений в различных областях науки и техники.
Использование реакции металлов и солей в практических целях

Реакция металлов с солями является важным процессом, который широко применяется в различных практических целях. Один из наиболее известных примеров такого использования - гальваническая коррозия, которая является основой для создания гальванических элементов и аккумуляторов.
Алксальные и щелочные металлы, такие как натрий и калий, активно реагируют с водой, образуя щелочные гидроксиды и высвобождая водород. Эта реакция используется в производстве гидрогенометаллов, где водород выступает в роли клеящей и восстанавливающей составляющей.
Также, некоторые металлы могут реагировать с соляными растворами для создания различных пигментов или красителей. Например, реакция железа с соляной кислотой может привести к образованию пигмента - ферроценового желтого. Этот пигмент широко используется в производстве красок и пластиковых материалов.
Некоторые металлы могут образовывать специфические соли, которые также используются в различных областях. Например, серебряные соли, такие как серебро нитрат, используются в фотографии для создания черно-белых изображений. Они реагируют с светом, что приводит к образованию металлического серебра, которое видно на пленке или фотобумаге.
Вопрос-ответ

Какие металлы реагируют с солью?
Многие металлы могут реагировать с солью. Например, активные металлы, такие как натрий, калий и магний обычно реагируют с хлоридами и другими солями, образуя соответствующие металлические хлориды. Более реактивные металлы, такие как алюминий и цинк, могут реагировать с солью образуя соответствующий металлический оксид. Некоторые металлы, такие как серебро и медь, могут реагировать с хлоридами, образуя металлический хлорид и осаждая хлор из раствора.
Какие металлы не реагируют с солью?
Некоторые металлы не реагируют с солью. Например, железо, золото и платина являются довольно неподвижными металлами и обычно не реагируют с солями. Это связано с их химической инертностью. Однако, некоторые металлы могут реагировать с определенными солями, поэтому нужно учитывать конкретные условия реакции.
