Гальваническая пара представляет собой электрохимическую систему, в которой два различных металла соединены проводником и погружены в электролит. Принцип действия гальванической пары основан на разности в электрохимическом потенциале между этими металлами. Это приводит к тому, что металл с большим потенциалом (который называется анодом) окисляется, переходя в ионное состояние и отдавая электроны проводнику. В то же время, металл с меньшим потенциалом (который называется катодом) восстанавливается, принимая электроны от проводника.
Важную роль в гальванической паре играет выбор металлов, которые будут использоваться. Разные металлы имеют различные электрохимические потенциалы, которые могут быть определены в некоторой шкале. Эта разница в потенциале влияет на направление электрохимической реакции и скорость ее протекания. Например, если анодом является цинк, а катодом - медь, то реакция будет протекать так, что цинк будет окисляться и выделять электроны, а медь будет принимать электроны и восстанавливаться.
Влияние выбора металлов на электрохимические реакции проявляется не только в направлении реакции и скорости ее протекания, но и в других факторах. Например, разная активность различных металлов может привести к необратимым электролизам, при которых металлы, окисляющиеся на аноде, растворяются в электролите, что может вызывать коррозию и повреждение материала. Также, например, при использовании металлов, которые образуют стойкие оксидные пленки, можно получить защитные покрытия от коррозии.
Влияние металлов на электрохимические реакции

Металлы играют важную роль в электрохимических реакциях благодаря своим химическим свойствам и способности вступать в гальваническую пару. Они могут выступать в качестве электродов, которые взаимодействуют с растворами электролитов и участвуют в процессах окисления и восстановления в электролитах.
Каждый металл влияет на электрохимические реакции по-разному. Ряд электродного потенциала представляет отношения между различными металлами и их способностью осуществлять электронный перенос в электролите. Металл с более положительным потенциалом будет иметь склонность к окислению, а металл с более отрицательным потенциалом будет иметь склонность к восстановлению.
При создании гальванической пары металлы могут взаимодействовать с растворами электролитов, образуя разные ионы. При этом металл, имеющий более положительный потенциал, будет переходить в раствор в форме положительного иона, а металл с более отрицательным потенциалом будет переходить в раствор в форме отрицательного иона.
Влияние металлов на электрохимические реакции может быть использовано в различных промышленных и научных областях. Например, в гальванических элементах и аккумуляторах металлы помогают создавать электрическую энергию путем электрохимических реакций. Кроме того, металлы также могут использоваться для защиты от коррозии путем создания непроницаемой оксидной пленки на поверхности металла.
Роль металлов в гальванической паре

Металлы играют ключевую роль в гальванической паре, обеспечивая протекание электрохимических реакций. Гальваническая пара состоит из двух различных металлов, которые образуют электрическую цепь. Одно из металлов выступает в роли анода, а другое - в роли катода.
Когда разные металлы погружаются в раствор электролита, происходят окислительно-восстановительные реакции. Металл анодной части пары становится анодом, отдавая электроны на электролит, и происходит окисление этого металла. Металл катодной части пары становится катодом, принимая электроны от электролита, и происходит восстановление этого металла.
Электроны, выделяющиеся на аноде, перемещаются по проводу к катоду, создавая электрический ток. Этот ток позволяет использовать гальванические пары в различных устройствах, таких как батарейки и аккумуляторы.
Выбор металлов для гальванической пары невероятно важен, потому что их химическая активность напрямую влияет на скорость и эффективность электрохимических реакций. Например, металлы с большей химической активностью склонны активно реагировать с электролитом, что приводит к более интенсивным электрохимическим реакциям.
Как работает гальваническая пара?
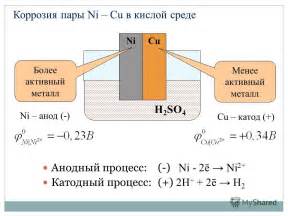
Гальваническая пара - это электрохимическая система, состоящая из двух различных металлов, соединенных проводом и погруженных в электролит. Работа гальванической пары основана на разности электрохимического потенциала или электродного потенциала металлов, которые обусловлены различием активности металлов в растворе.
Когда два различных металла соединены проводом, образуется электрическая цепь, через которую между металлами начинает протекать электродный потенциал, создавая электрический ток. В этой цепи один металл будет выступать в качестве анода, где происходит окисление, а другой металл будет выступать в качестве катода, где происходит восстановление.
При этом, металл с более низким электродным потенциалом будет выделяться и растворяться в электролите, а металл с более высоким электродным потенциалом будет осаждаться на поверхности катода. Таким образом, гальваническая пара способна генерировать электрическую энергию.
Влияние гальванической пары на электрохимические реакции проявляется в том, что электронный перенос между металлами позволяет протекать реакциям окисления и восстановления. Это может быть использовано для преобразования химической энергии в электрическую энергию, а также для катодной защиты от коррозии.
Электрохимические реакции между металлами
Металлы, составляющие гальваническую пару, взаимодействуют между собой, образуя электрохимические реакции. Эти реакции основаны на том, что разные металлы имеют различную способность отдавать или принимать электроны.
В электрохимической реакции между металлами один из металлов, называемый анодом, окисляется, теряя электроны. Другой металл, называемый катодом, принимает эти электроны. Такое взаимодействие между металлами может происходить в присутствии электролита, который обеспечивает проводимость ионов.
Когда два металла контактируют друг с другом, возникает потенциальная разница, которая приводит к перемещению электронов от металла с более низкой степенью активности к металлу с более высокой степенью активности. Эта разница в активности металлов называется электропотенциалом. Чем больше электропотенциал разных металлов, тем больше вероятность их электрохимической реакции.
Электрохимические реакции между металлами могут привести к образованию осадков на поверхности одного из металлов или к коррозии металла. Например, если металл с более высокой степенью активности находится в контакте с металлом с более низкой активностью, активный металл может испытывать коррозию.
Выводящаяся из электрохимических реакций между металлами практическая польза заключается в возможности создания гальванических элементов и аккумуляторов. В таких устройствах происходит спонтанное протекание электрохимических реакций, что позволяет получать электрическую энергию.
Принцип работы гальванической пары

Гальваническая пара представляет собой электрохимическую систему, состоящую из двух разных металлических электродов, соединенных проводником. Один из электродов обычно называется анодом, а другой – катодом. Гальваническая пара действует на основе принципа электродных потенциалов: разные металлы имеют разную склонность отдавать или принимать электроны.
Когда анод и катод подключены проводником, начинается электрохимический процесс. Анод теряет электроны и окисляется, при этом образуется положительно заряженный ион металла. Эти электроны перемещаются по проводнику к катоду, где они принимаются. Катод получает электроны от анода и восстанавливается. Таким образом, в гальванической паре электроны переносятся от анода к катоду через внешнюю цепь.
Важным фактором в работе гальванической пары является разность потенциалов между анодом и катодом. Чем больше разница в потенциалах, тем сильнее будет течь электрохимическая реакция. Относительная активность металлов определяет, какой из них будет анодом, а какой – катодом. Металл с более высоким потенциалом наконец-то истекает электронами и окисляется, а металл с более низким потенциалом принимает электроны и восстанавливается.
Гальванические пары широко используются, например, в батарейках и аккумуляторах. Также гальванические пары играют важную роль в области катодной защиты металлов от коррозии. Изучение гальванических пар и их влияние на электрохимические реакции помогает лучше понять принципы работы электрохимических систем и их применение в различных областях техники и науки.
Выбор металлов для гальванической пары
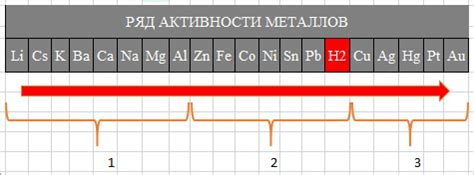
Выбор металлов для гальванической пары играет важную роль в электрохимических реакциях, происходящих в системе. Для образования гальванической пары необходимо, чтобы один металл был более активным, а другой - менее активным.
Более активный металл в паре будет выступать в роли анода, тогда как менее активный - в роли катода. Разность потенциалов между этими металлами приводит к тому, что электроны переходят с анода на катод, образуя ток.
При выборе металлов для гальванической пары следует учитывать их электрохимические свойства. Желательно, чтобы разность потенциалов между металлами была достаточно велика, чтобы обеспечить эффективное протекание электрохимической реакции. Также важно учитывать степень коррозионной стойкости металлов, чтобы избежать быстрой деградации системы.
Для выбора металлов можно использовать таблицу электрохимической активности металлов. На основании этой таблицы можно сравнить потенциалы различных металлов и выбрать такие, разность потенциалов между которыми будет достаточно большой для обеспечения эффективности работы гальванической пары.
Важно также учитывать окружающую среду, в которой будет использоваться гальваническая пара, так как она может влиять на коррозионные процессы металлов. Например, в среде, содержащей кислород, металлы могут подвергаться окислению и коррозии. Поэтому необходимо тщательно подбирать металлы с учетом условий эксплуатации.
Расчет и прогнозирование электрохимических реакций

Расчет и прогнозирование электрохимических реакций является важной задачей в области химии и электрохимии. Данная процедура позволяет определить, какие вещества будут переходить в состояние ионов и какие реакции протекают при соединении различных металлов.
Для расчета электрохимической реакции применяются определенные правила и табличные данные. Вначале необходимо определить электродный потенциал каждого металла, который является мерой его способности участвовать в электрохимических реакциях. На основе этих данных можно сделать прогноз о том, какие металлы будут реагировать друг с другом и какие электроды будут образовываться.
Для более точного расчета электрохимических реакций используется уравнение Нернста, которое учитывает концентрации ионов и температуру реакции. Это уравнение позволяет определить электродный потенциал в зависимости от данных параметров и прогнозировать направление электрохимической реакции.
Основываясь на полученных данных, можно сделать выводы о том, какие металлы способны реагировать между собой в гальванической паре и какие электрохимические реакции будут протекать. Этот подход позволяет определить возможность выполнения конкретных электрохимических процессов и использовать их в практических целях, например, в производстве аккумуляторных батарей или водородных топливных элементов.
Вопрос-ответ

Каков принцип действия гальванической пары?
Принцип действия гальванической пары заключается в возникновении электрического тока при взаимодействии двух различных металлов в электролите. При этом один из металлов выступает в роли анода, на котором происходит окисление, а другой - в роли катода, на котором происходит восстановление. Ток электронов и ионов перемещается от анода к катоду по внешней электрической цепи, что приводит к образованию электрического тока.
Влияют ли металлы, составляющие гальваническую пару, на электрохимические реакции?
Да, металлы, составляющие гальваническую пару, оказывают влияние на электрохимические реакции. Реакции, которые происходят на аноде и катоде, зависят от химических свойств металлов. Например, различные металлы имеют разную склонность к окислению или восстановлению, что определяет направленность реакций. Кроме того, различные металлы могут иметь различную электрохимическую активность, что влияет на скорость реакций и электрический потенциал гальванической пары.
