Радиус атома - один из основных параметров элемента, важный для понимания его химических и физических свойств. В случае металлов радиус атома играет особую роль, поскольку он оказывает существенное влияние на различные свойства веществ.
Радиус атома металла определяется расстоянием от центра ядра до края электронной оболочки. Он является ключевым фактором, определяющим связи и взаимодействия в металлической решетке. Больший радиус атома в металлах обусловлен наличием слабой валентной связи и большими промежутками между атомами в кристаллической структуре.
Большой радиус атома металла позволяет легко перемещаться электронам внутри решетки и создавать электронные облака. Это облегчает проводимость тепла и электричества, делая металлы отличными электропроводниками. Более того, большой радиус атома металла обусловливает его хорошие деформационные свойства и способность принимать любую форму при обработке.
Влияние радиуса атома на свойства металлов заметно также при смешивании различных металлов. Изменение радиуса атома влияет на степень растворимости различных металлов и структуру сплавов. Благодаря этому свойству металлы могут быть сплавлены вместе, создавая материалы с улучшенными характеристиками для конкретных применений.
Радиус атомов металлов: понятие и значение
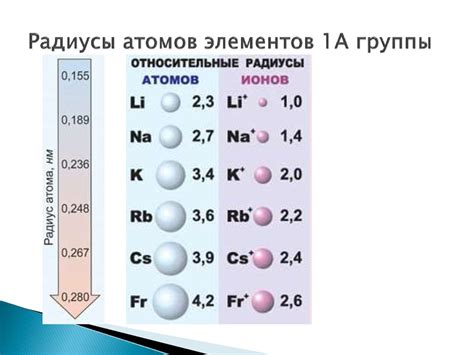
Радиус атома металла - это характеристика, которая определяет размер атома данного металла. Размер атома имеет огромное значение в понимании и объяснении свойств веществ, содержащих металлы. Он влияет на такие важные характеристики, как электронное строение, химическая активность и физические свойства металла.
Радиус атома металла зависит от его атомного номера и положения в периодической системе элементов. Периодическая система располагает металлы слева от периодического столбца и имеет тенденцию увеличивать радиус атома сверху вниз в каждом периоде. Это связано с увеличивающейся электронной оболочкой и возрастающим числом электронных оболочек, что приводит к увеличению размера атома.
Размер атомов металлов имеет прямое влияние на их свойства. Большие атомы металлов обычно имеют более слабую связь между атомами и, следовательно, более высокую пластичность и деформируемость. Они также могут иметь более слабую межатомную связь, что способствует легкому движению электронов между атомами.
С другой стороны, маленькие атомы металлов имеют более сильные связи, что делает их твёрже и менее деформируемыми. Они также обычно имеют более высокие температуры плавления и кипения. Маленький радиус атома может также влиять на размеры пустот в кристаллической решетке, что может приводить к изменению магнитных и оптических свойств металла.
Таким образом, радиус атомов металлов играет важную роль в определении их химического и физического поведения. Изучение и понимание этого параметра позволяет предсказывать и объяснять свойства металлов и их соединений, а также способствует развитию и применению новых материалов с улучшенными свойствами.
Взаимосвязь радиуса атомов металлов и их свойств

Радиус атома – это фундаментальная характеристика атома, которая зависит от количества электронов в его электронной оболочке. Размер и форма атома металла определяются распределением электронной плотности и электрическим зарядом ядра.
Радиус атома металла оказывает значительное влияние на множество свойств вещества, включая его физические и химические свойства. Во-первых, радиус атома металла определяет его плотность. Чем больше радиус атома, тем меньше плотность металла, так как физический объем атома увеличивается.
Во-вторых, радиус атома металла влияет на его механические свойства, такие как твердость и пластичность. Большие атомы металлов обладают большей пластичностью, поскольку они имеют большую способность к деформации без разрушения. Однако, с увеличением радиуса атома металла уменьшается его твердость.
Кроме того, радиус атома металла оказывает влияние на его химические свойства, такие как активность и реакционная способность. Маленькие атомы металлов имеют большую реакционную способность, так как они могут легче обмениваться электронами с другими атомами. Большие атомы металлов, напротив, имеют меньшую реакционную способность и могут образовывать более стабильные соединения.
Таким образом, радиус атома металла является ключевым параметром, влияющим на его свойства. Знание радиуса атомов металлов позволяет предсказывать и объяснять их физические и химические свойства, а также осуществлять выбор и оптимизацию материалов с необходимыми характеристиками.
Влияние радиуса атомов металлов на плотность и плавление
Радиус атомов металлов играет важную роль в определении их физических свойств, таких как плотность и температура плавления.
С увеличением радиуса атомов металлов обычно увеличивается их плотность. Это связано с тем, что при увеличении радиуса атомов вещество становится более плотным, так как большие атомы занимают больше пространства и создают более компактную решетку. Благодаря этому, металлы с большими радиусами атомов будут обычно более плотными, чем металлы с меньшими радиусами атомов.
Также радиус атомов металлов может влиять на их температуру плавления. Обычно, металлы с большими радиусами атомов имеют более высокую температуру плавления, чем металлы с меньшими радиусами атомов. Причина этого заключается в том, что большие атомы образуют более крепкие и стабильные связи между атомами, что требует большего количества энергии для разрушения этих связей и перехода в жидкое состояние.
Однако, следует отметить, что влияние радиуса атомов на плотность и плавление может быть сложным и зависит от многих факторов, включая такие как электронная структура материала, особенности его решетки и присутствие дефектов.
В целом, радиус атомов металлов оказывает значительное влияние на их физические свойства, включая плотность и температуру плавления. Понимание этого влияния может быть полезно в области материаловедения и в разработке новых материалов с определенными желаемыми свойствами.
Радиус атомов металлов и химическая реактивность
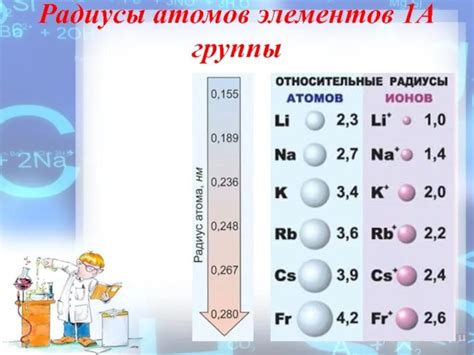
Радиус атомов металлов - один из основных параметров, определяющих химическую реактивность элементов. Размер атомов металлов влияет на образование и характеристики связей между атомами в металлической решетке, а также на их способность вступать в химические реакции.
Малый радиус атомов металлов, таких как литий, натрий или алюминий, позволяет им образовывать более крепкие металлические связи в решетке. Это делает их более прочными и пластичными материалами, что оказывает влияние на их физические свойства, такие как температура плавления и теплопроводность.
Большой радиус атомов металлов, например, золота или свинца, обусловливает более слабые металлические связи, что делает эти элементы менее прочными и пластичными. Однако, большой размер атомов металлов способствует образованию более слабых связей с другими элементами, позволяя им легче вступать в химические реакции.
Таким образом, радиус атомов металлов оказывает влияние на их химическую реактивность. Металлы с меньшим радиусом обычно проявляют большую наклонность к образованию металлических связей, в то время как металлы с большим радиусом чаще образуют соединения с другими элементами, так как их атомы легче вступают в химические реакции.
Значение радиуса атомов металлов в технологических процессах
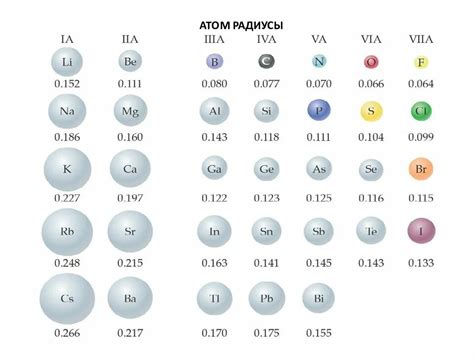
Радиус атомов металлов является одним из ключевых параметров, определяющих их свойства и поведение в различных технологических процессах. Например, в процессе формирования металлических соединений или сплавов радиус атомов металлов играет важную роль.
Большой радиус атомов металлов, таких как натрий или калий, способствует формированию их ионов в процессе реакций. Ионы металлов имеют положительный заряд и являются ключевыми участниками во многих химических реакциях и процессах, таких как электролиз или выделение металла из его руды.
С другой стороны, маленький радиус атомов металлов, таких как медь или железо, может способствовать образованию прочных металлических связей и структур. Малые атомы металлов могут компактно располагаться в решетке кристалла и создавать сильные связи между собой. Это делает такие металлы прочными и устойчивыми к деформациям и повреждениям.
Значение радиуса атомов металлов также может влиять на их электропроводность. Большой радиус атомов металлов, таких как алюминий или магний, может способствовать лучшей проводимости электрического тока, так как больше электронов свободно двигаются внутри металлической структуры.
Суммируя, радиус атомов металлов имеет огромное значение в технологических процессах, определяя свойства и поведение металлов при различных химических реакциях и технологиях. Большие или маленькие радиусы могут определять структуру, прочность или электропроводность металлов, и должны учитываться при разработке и оптимизации процессов производства металлов и их сплавов.
Изменение радиуса атомов металлов в периодической таблице
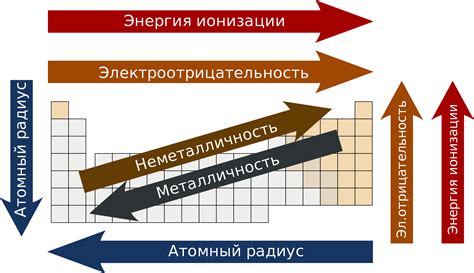
Радиус атома - одна из основных характеристик, определяющих свойства вещества. В периодической таблице металлы расположены в левой части и имеют большие радиусы атомов по сравнению с неметаллами.
Изменение радиуса атомов металлов в периодической таблице обусловлено строением электронной оболочки. Количество электронов и их энергетический уровень влияют на радиус атома.
В периодической таблице радиус атомов металлов увеличивается по мере движения вниз по группе и уменьшается по мере движения слева направо по периоду. Это связано с увеличением количества энергетических уровней и электронов в атоме при движении вниз по группе, что приводит к увеличению размеров атома.
При движении слева направо по периоду, количество электронов в атоме увеличивается, но число энергетических уровней остается постоянным. Это приводит к сокращению радиуса атома металла.
Изменение радиуса атомов металлов в периодической таблице влияет на их химические, физические и механические свойства. Увеличение радиуса атома может способствовать увеличению межатомных расстояний и позволить большему движению электронов, что влияет на электропроводность металлов.
Кроме того, радиус атомов металлов влияет на их плотность, термическую и электрическую проводимость, а также на их способность образовывать сплавы и соединения с другими элементами. Понимание изменения радиуса атомов металлов помогает объяснить и предсказать их свойства и взаимодействия с другими веществами.
Вопрос-ответ

Каково определение радиуса атомов металлов?
Радиус атома металла - это расстояние от ядра атома до его внешней электронной оболочки. Он является основной характеристикой металла и определяет его размер и свойства.
Как радиус атомов металлов влияет на их свойства?
Радиус атомов металлов влияет на их свойства во многих аспектах. Например, большой радиус атома обусловливает большую прочность и пластичность металла, тогда как малый радиус обычно делает металл более твердым и хрупким. Кроме того, радиус атомов влияет на их способность проводить электричество и тепло. Чем меньше радиус, тем выше электропроводность и теплопроводность.
