Оксиды металлов являются одной из самых важных и широко распространенных групп неорганических соединений. Несмотря на это, они не относятся к сложным веществам, так как их структура и состав достаточно просты и легко исследуемы. Основой оксидов металлов является кислород, который соединяется с металлическими ионами в химических реакциях.
Оксиды металлов имеют широкий спектр свойств и применений. Они могут быть как кислотными, так и щелочными, a их растворы обладают различными свойствами. Некоторые оксиды металлов обладают полупроводниковыми свойствами, что делает их важными материалами для электронной промышленности.
Важно отметить, что оксиды металлов широко используются в природе. Например, оксид железа, известный как ржавчина, является одним из самых распространенных оксидов металлов. Он встречается в природе в виде минерала гематита и используется в производстве стали и других металлов.
Оксиды металлов также используются в производстве косметических и фармацевтических препаратов, керамики, стекла и других материалов. Они обладают высокой химической стабильностью и способностью к термической обработке, что делает их важными компонентами в различных отраслях промышленности.
Таким образом, оксиды металлов являются важными и широко распространенными соединениями, которые неотъемлемы для многих промышленных процессов и имеют различные применения как в естественных, так и в искусственных условиях. Их простая структура и свойства делают их доступными для исследования и использования в различных областях науки и технологии.
Оксиды металлов: простые вещества или сложные соединения?
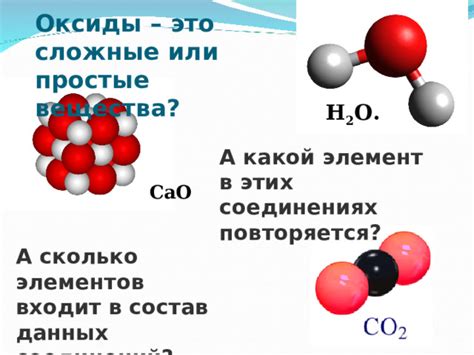
Оксиды металлов - это химические вещества, состоящие из атомов металла и кислорода. Несмотря на то, что оксиды металлов содержат металлы, они не относятся к простым веществам, а являются сложными соединениями. Оксиды металлов образуются в результате реакции металлов с кислородом, как в атмосфере, так и в реакционных средах.
Стоит отметить, что оксиды металлов выражают степень окисления металла и составляют важную часть химии металлов. Они могут иметь различные свойства в зависимости от типа металла и различных условий образования. Некоторые оксиды металлов являются основаниями, другие - кислотами, а некоторые могут быть и амфотерными, то есть реагировать и с кислотами, и с основаниями.
Оксиды металлов имеют широкий спектр применений. Они используются в металлургии для получения металлов, в качестве катализаторов в химических реакциях, в производстве стекла и керамики, а также в электронике и других отраслях промышленности. Оксиды металлов также играют важную роль в природе и экосистемах, влияя на химические процессы и поглощение кислорода.
- Оксиды металлов можно классифицировать по составу, свойствам и степени окисления металла.
- Некоторые известные оксиды металлов включают оксид железа (FeO), оксид алюминия (Al2O3), оксид кальция (CaO) и оксид меди (CuO).
- Важно понимать, что оксиды металлов представляют собой химические соединения и могут образовывать различные структуры, такие как кристаллические решетки или аморфные вещества.
Таким образом, оксиды металлов не являются простыми веществами, а представляют собой сложные соединения, которые имеют важное значение в химии и промышленности. Изучение и понимание свойств оксидов металлов позволяет расширить наши знания о химии металлов и использовать их в различных областях знаний и практической деятельности.
Состав и структура оксидов металлов
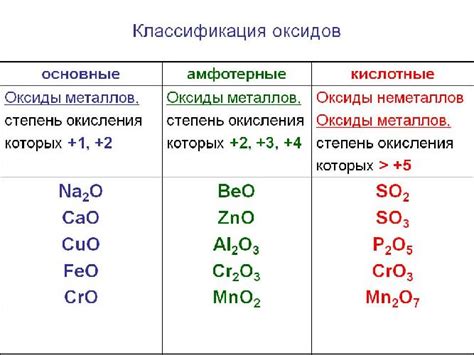
Оксиды металлов являются химическими соединениями, состоящими из металла и кислорода. Обычно они получаются в результате реакции металла с кислородом или окислением металла. Оксиды металлов обладают разнообразной структурой и составом, что обусловлено различными свойствами и степенями окисления металла.
В оксидах металлов обычно присутствует один или несколько атомов металла, которые соединены с атомами кислорода. Количество атомов кислорода в оксидах может быть разным и определяется степенью окисления металла. Например, оксид железа (III) Fe2O3 состоит из двух атомов железа и трех атомов кислорода.
Структура оксидов металлов может быть кристаллической или аморфной. Кристаллическая структура характеризуется регулярным расположением атомов, а аморфная - хаотичным расположением атомов и отсутствием определенных регулярных форм. Кристаллические оксиды металлов могут иметь различные типы кристаллической решетки, такие как кубическая, гексагональная или кубоидальная.
Оксиды металлов обладают разнообразными физическими и химическими свойствами. Они могут быть как газообразными, так и твердыми веществами. Многие оксиды металлов обладают высокой температурной стабильностью и являются непроводящими электрического тока. Однако некоторые оксиды металлов, например, оксиды серы и меди, обладают полупроводниковыми свойствами и могут использоваться в электронике и полупроводниковых приборах.
Физические свойства оксидов металлов

Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они имеют разнообразные физические свойства, которые определяют их состояние и поведение в различных условиях.
Точка плавления и кипения: Как и большинство неорганических соединений, оксиды металлов обладают высокими точками плавления и кипения. Это связано с их кристаллической структурой и прочными химическими связями между элементами.
Твердотельные свойства: Оксиды металлов могут быть твердыми, кристаллическими веществами. Их твердость и прочность зависят от типа кристаллической решетки и взаимного расположения атомов вещества.
Электрическая проводимость: Некоторые оксиды металлов обладают электрической проводимостью. Это связано с наличием свободных электронов в оксидной решетке, которые могут двигаться по твердому веществу. Такие оксиды металлов называются полупроводниками.
Растворимость: Оксиды металлов могут быть различно растворимы в воде и других растворителях. Некоторые оксиды образуют щелочные растворы, которые обладают щелочной реакцией и могут взаимодействовать с кислотами.
Цветность: Многие оксиды металлов обладают характерными цветами, которые могут быть использованы для их идентификации. Например, оксид железа(III) обычно имеет красноватый цвет, оксид меди(II) – чорный, а оксид цинка – белый.
В целом, физические свойства оксидов металлов очень разнообразны и определяются как химическим составом, так и кристаллической структурой этих соединений. Изучение этих свойств позволяет лучше понять и использовать оксиды металлов в различных областях науки и техники.
Реакционная способность оксидов металлов
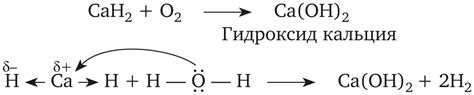
Оксиды металлов являются основными соединениями, образующимися при взаимодействии металлов с кислородом или воздухом. Они отличаются высокой реакционной способностью, что позволяет им находить широкое применение в различных отраслях промышленности и науки. При контакте с водой оксиды металлов подвергаются гидролизу, то есть реагируют с молекулами воды. Это приводит к образованию щелочей или кислот в зависимости от реактивности металла.
Оксиды металлов также обладают сильной окислительной способностью. Они способны окислять другие вещества, переходя самостоятельно в более низкую степень окисления. Эта реакция может происходить при контакте с веществами, содержащими активные восстановители, либо при повышенной температуре. Так, например, оксид железа Fe2O3 может взаимодействовать с углеродом в особо нагретом состоянии, образуя угарный газ и металлическое железо.
Оксиды металлов также часто используются в качестве катализаторов в различных химических реакциях. Они способны активировать молекулы, участвующие в процессе, и ускорять химическую реакцию. Благодаря своей высокой реакционной способности, оксиды металлов могут быть использованы в производстве керамики, стекла, металлургии, производстве аккумуляторов и других промышленных процессах.
Интересно отметить, что реакционная способность оксидов металлов может зависеть от их структуры и состава. Например, металлические оксиды с кристаллической структурой могут обладать большей реакционной способностью по сравнению с аморфными или аморфно-кристаллическими соединениями. Также влияние на реакционную способность оксидов металлов может оказывать их пористость, которая определяет доступность молекул к местам реакции.
Роль оксидов металлов в жизни человека

Оксиды металлов - это важные химические соединения, на которых базируется множество процессов в жизни человека. Одной из главных ролей оксидов металлов является их использование в промышленности.
Оксид алюминия используется в производстве стекла, катализаторов, лакокрасочных материалов и других материалов. Он также присутствует в составе многих строительных материалов, например, в кирпиче и бетоне.
Оксид железа является основной компонентой красок, пигментов и эмалей. Он используется для окрашивания различных материалов, таких как металлы, стекло, пластик и древесина. Также он является частью магнитных материалов и используется в производстве магнитов.
Оксид цинка широко применяется в косметической промышленности, где он используется в производстве солнцезащитных средств и косметических продуктов. Он также является важным компонентом в производстве аккумуляторов, керамики и резины.
Оксид титана находит применение в производстве красок, пигментов, лаков, пластиков и косметических продуктов. Он также используется в солнечных батареях, электродах и стеклах.
Оксид алюминия и оксид титана часто используются для создания катализаторов, которые ускоряют химические реакции и применяются в различных промышленных процессах.
Оксиды металлов также играют важную роль в медицине. Например, оксид железа используется в производстве лекарственных препаратов и добавок к пище, благодаря своим полезным свойствам для организма.
Также следует отметить, что оксиды металлов имеют значительное значение в области энергетики. Оксид никеля используется в производстве никель-кадмиевых аккумуляторов, которые нашли широкое применение в электротранспорте и телекоммуникациях.
В заключение, оксиды металлов играют важную роль в различных сферах жизни человека, от промышленности и медицины до энергетики и косметологии. Их свойства и возможности постоянно исследуются и применяются для улучшения качества жизни и развития технологий.
Вопрос-ответ

Какие вещества относятся к сложным?
К сложным веществам обычно относятся соединения, состоящие из большого количества атомов, и имеющие сложную структуру. В противоположность им, оксиды металлов состоят из двух элементов - металла и кислорода, поэтому их можно назвать простыми веществами.
Почему оксиды металлов не считаются сложными веществами?
Оксиды металлов не считаются сложными веществами, потому что они состоят из двух элементов - металла и кислорода, и имеют простую структуру. Сложные вещества обычно состоят из большого количества атомов и имеют более сложную структуру.
Какова структура оксидов металлов?
Оксиды металлов имеют простую структуру и состоят из двух элементов - металла и кислорода. Металлы обычно образуют ионы положительного заряда, а кислород образует ион отрицательного заряда. Эти ионы образуют кристаллическую решетку, в которой каждый ион металла окружен ионами кислорода.
Почему оксиды металлов не являются сложными веществами?
Оксиды металлов не являются сложными веществами, поскольку они имеют простую структуру и состоят всего из двух элементов - металла и кислорода. Сложные вещества, напротив, состоят из большого количества атомов и имеют более сложную структуру, что делает их сложными для изучения и химического анализа.
