Хлор (Cl) — это один из самых распространенных химических элементов, который обладает большим количеством применений в различных областях, включая промышленность и медицину. Важным аспектом взаимодействия хлора с другими веществами является его способность образовывать оксиды или соли с металлами. При этом каждый металл может иметь различные степени окисления, что оказывает влияние на свойства и реакции этих соединений.
Определение степени окисления металла в соединении с хлором является важной задачей в химии. Для этого используется ряд методов, включая визуальные наблюдения, измерение электрической проводимости, анализ спектров и т.д. Определение степени окисления позволяет понять, какие электроны перекачиваются от металла к хлору, что имеет существенное значение для объяснения и предсказания реакций тех или иных соединений.
Существует несколько факторов, которые влияют на степень окисления металлов в соединениях с хлором. Один из таких факторов — электроотрицательность хлора. Чем выше электроотрицательность хлора, тем выше степень окисления металла. Кроме того, важными факторами являются структура кристаллической решетки соединения и его зарядовое состояние. Все эти факторы вместе определяют характер и интенсивность взаимодействия металла с хлором.
Химический элемент хлор и его взаимодействие с металлами

Хлор — химический элемент, принадлежащий к группе галогенов в периодической системе. Он обладает высокой химической активностью и широко используется в различных процессах. Хлор имеет острую характеристику запаха и является ядовитым газом.
Взаимодействие хлора с металлами основывается на его способности окислять ионизировать металлические элементы. При контакте с металлом хлор может привести к образованию соли, например, хлоридов. Такое взаимодействие может происходить как в газообразной фазе, так и в жидкой или твердой.
Степень окисления хлора во время его взаимодействия с металлами может изменяться в зависимости от конкретных условий реакции. Часто хлор взаимодействует с металлами, образуя хлориды с различными степенями окисления, например, хлориды с +1, +3, +5 и т.д. Это позволяет определить степень окисления хлора в процессе реакции.
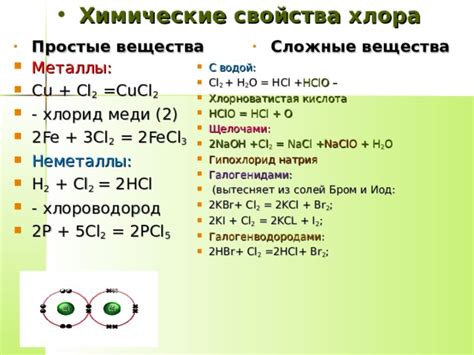
В качестве примера можно рассмотреть реакцию хлора с натрием: 2Na + Cl2 → 2NaCl. В данном случае хлор окисляет натрий до степени окисления +1, образуя хлорид натрия. Подобные реакции могут происходить с различными металлами и позволяют определить степень окисления хлора в соответствующих хлоридах.
Взаимодействие хлора с металлами имеет широкое применение в химической промышленности, при производстве различных соединений и материалов. Правильное определение степени окисления хлора позволяет контролировать процессы и обеспечивать нужные химические свойства получаемых продуктов.
Свойства хлора и его роль в химических реакциях

Хлор – это химический элемент из группы галогенов, обладающий рядом уникальных свойств. Он является желтовато-зеленого цвета газом с характерным запахом. Хлор обладает высокой реакционной способностью и активно взаимодействует с различными веществами, включая металлы.
Одной из важных ролей хлора в химических реакциях является его способность к окислению и восстановлению. Хлор способен давать электроны в процессе реакции, что позволяет ему выступать как окислитель. Процессы окисления и восстановления, в которых участвует хлор, широко применяются в различных областях химии и промышленности.
Хлор также служит важным компонентом при производстве различных химических продуктов, таких как пластик, соли, хлороорганические соединения и многие другие. Большинство этих производственных процессов основаны на способности хлора образовывать стабильные соединения с различными элементами.
Кроме того, хлор играет важную роль в очистке воды и водоочистных процессах. Хлор используется в виде гипохлоритов для уничтожения бактерий, вирусов и других микроорганизмов в питьевой и промышленной воде.
Взаимодействие хлора с металлами может происходить различными способами, включая аддиционные и реакционные редокс-процессы. Результаты этих реакций могут зависеть от степени окисления хлора и его концентрации.
Реакции с хлором и металлами

Хлор – один из самых активных галогенов, который может образовывать реакции с различными металлами. Взаимодействие хлора с металлами происходит в результате передачи электронов от металла к хлору и образования ионов металла в соответствующем окислительно-восстановительном процессе.
С помощью реакций с хлором можно определить степень окисления металлов. Для этого проводят химические эксперименты, в которых металлы соответствующей степени окисления реагируют с хлором. В результате реакции образуются хлориды металлов, которые можно идентифицировать при помощи различных аналитических методов.
Важно отметить, что реакции с хлором и металлами могут протекать по-разному в зависимости от степени окисления металлов. Например, щелочные металлы, такие как натрий и калий, реагируют с хлором с образованием хлоридов и обычно происходит выделение газа.
Один из способов определения степени окисления металлов в реакциях с хлором – использование таблиц стандартных электродных потенциалов. При данном методе сравниваются электродные потенциалы металлов и их соответствующих ионов в растворе. Это позволяет установить, что металлы с наибольшей разницей электродных потенциалов более активны и легко реагируют с хлором.
Окислительные свойства хлора и его влияние на металлы
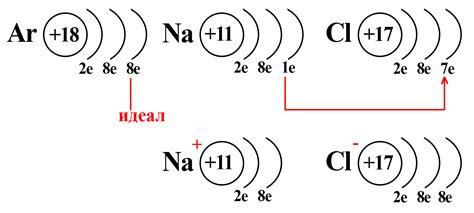
Хлор – это химический элемент с атомным номером 17 и общей электронной конфигурацией 2,8,7. В периодической системе его обозначают символом Cl. У хлора присутствуют сильные окислительные свойства, которые проявляются в его взаимодействии с металлами.
Металлы обычно имеют склонность отдавать электроны, образуя положительные ионы. Хлор, будучи сильным окислителем, стремится присоединить эти электроны и образовать отрицательные ионы хлорида. Таким образом, хлор оказывает окислительное воздействие на металлы.
При взаимодействии хлора с металлами обычно происходит окисление металла, а хлор сам получает электроны и восстанавливается. Это процесс, называемый реакцией окисления-восстановления. Результатом взаимодействия хлора с металлами может быть образование соединений хлорида металла.
Окислительные свойства хлора позволяют использовать его для различных промышленных процессов, таких как производство хлороводородной кислоты, отбеливание и дезинфекция воды, а также для производства полимеров и пластмасс. Однако необходимо быть осторожным при обращении с хлором, так как он является ядовитым и опасным веществом.
Определение степени окисления металлов в реакциях с хлором
Взаимодействие хлора с металлами представляет собой одну из наиболее распространенных химических реакций. В химии степень окисления металла является отражением количества электронов, которые он отдает или принимает во время реакции. Определение степени окисления металлов в реакциях с хлором может быть произведено с помощью различных методов и аналитических приборов.
Один из методов определения степени окисления металлов в реакциях с хлором основан на измерении изменения заряда металла в хлориде, образующемся в результате реакции. Для этого используются различные электрохимические методы, такие как вольтамперометрия или потенциостатический анализ.
Другой метод определения степени окисления металлов в реакциях с хлором связан с изучением структуры и свойств образующихся соединений. Спектроскопические методы, такие как ядерный магнитный резонанс (ЯМР) или рентгеновская спектроскопия, позволяют определить электронную конфигурацию металла в соединении и тем самым установить его степень окисления.
Кроме того, химические методы, такие как реакция с другими веществами или изменение валентности металла, также могут быть использованы для определения степени окисления металлов в реакциях с хлором. Например, изменение цвета раствора или образование осадка может указывать на определенную степень окисления металла.
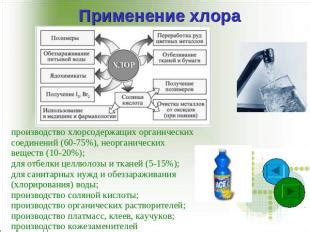
Области применения хлора в промышленности

Хлор – важный химический элемент, который широко используется в промышленности в различных областях. Его уникальные свойства и широкие возможности применения делают его неотъемлемой частью многих отраслей экономики.
1. Химическая промышленность: хлор используется для производства множества химических соединений, таких как хлорид кальция, каустическая сода, пластмассы, пестициды, красители и многие другие. Он является необходимым компонентом в процессе синтеза многих веществ и материалов.
2. Производство полимеров: хлор используется при получении поливинилхлорида (ПВХ), одного из самых распространенных полимеров в мире. ПВХ применяется в производстве различных изделий, включая строительные материалы, электроизоляцию, упаковочную промышленность и многое другое.
3. Водоподготовка: хлор используется в процессе очистки воды. Он является эффективным дезинфицирующим средством, которое уничтожает бактерии, вирусы и другие микроорганизмы, делая воду безопасной для питья и использования в бытовых и промышленных целях.
4. Производство бумаги и целлюлозы: хлор применяется в процессе получения целлюлозы и беления бумаги. Он способствует удалению органических веществ и отбеливанию, что позволяет получить высококачественную бумагу и целлюлозу.
5. Фармацевтическая промышленность: хлор используется при производстве многих медицинских препаратов. Он применяется в процессах синтеза активных веществ и дезинфекции оборудования, что обеспечивает высокий уровень гигиены и чистоты в процессе производства лекарственных средств.
Таким образом, хлор является важным компонентом в различных отраслях промышленности, обеспечивая высокую эффективность и качество производства в различных сферах.
Производство хлорсодержащих соединений
Хлор является важным химическим элементом, который находит широкое применение в различных отраслях промышленности. Для производства хлорсодержащих соединений применяются различные методы.
Один из основных способов производства хлора - это электролиз раствора хлорида натрия (NaCl). При электролизе происходит разложение воды на водород и кислород, а хлорида натрия - на натрий и хлор. Полученный хлор используется для производства множества химических соединений.
Другим методом производства хлорсодержащих соединений является окислительная хлорировка. В этом процессе хлор воздействует на органические или неорганические вещества, приводя к образованию хлорсодержащих соединений. Например, окислительная хлорировка может использоваться для получения хлорированных углеводородов или пестицидов.
Еще одним способом производства хлорсодержащих соединений является дегидратация. В этом процессе применяется высокая температура, что позволяет удалить из соединений молекулы воды. Например, хлор может быть получен путем дегидратации хлорида марганца (MnCl2).
- Электролиз
- Окислительная хлорировка
- Дегидратация
Вопрос-ответ

Как происходит взаимодействие хлора с металлами?
Взаимодействие хлора с металлами происходит путем образования ионов хлорида и ионов металла. Чаще всего металл отдает электроны и образует положительный ион, а хлор получает электроны и образует отрицательный ион, что и обеспечивает стабильную ионную связь. В зависимости от валентности металла и его способности отдавать электроны, степень окисления хлора может быть различной.
Как определить степень окисления хлора при взаимодействии с металлами?
Степень окисления хлора при взаимодействии с металлами можно определить по электроотрицательности металла. Если металл имеет низкую электроотрицательность и способен отдавать электроны хлору, то степень окисления хлора будет -1. Если металл имеет высокую электроотрицательность и более сильно притягивает электроны к себе, то степень окисления хлора будет положительной и зависит от валентности металла.
