Окисление металлов - один из наиболее распространенных процессов, которые происходят в природе и в промышленности. В ходе этого процесса металлы взаимодействуют с воздухом или другими веществами, что приводит к изменению их химических свойств. На первый взгляд может показаться, что окисление металлов является чисто химическим явлением, однако оно неразрывно связано с физическими процессами.
Окисление металлов происходит в результате химической реакции, когда металлы вступают в контакт с кислородом или другими оксидирующими агентами. При этом металлы могут испытывать изменение своей валентности и образование оксидов. Таким образом, окисление металлов - это химический процесс, в результате которого происходит изменение структуры и свойств металла.
Однако, окисление металлов также является физическим процессом, поскольку при нем происходят изменения в физической структуре и состоянии металлов. Процесс окисления может привести к образованию оксидной пленки на поверхности металла, которая может изменять его цвет, текстуру и другие физические свойства. Кроме того, окисленная поверхность металла может стать более хрупкой и менее стойкой к внешним воздействиям.
Таким образом, окисление металлов является сложным процессом, который объединяет в себе и химические, и физические аспекты. Понимание этого процесса не только важно для химиков и материаловедов, но и имеет практическое значение для разработки новых материалов, защиты от коррозии и улучшения свойств металлов.
Физическое и химическое окисление металлов: что это такое?
Окисление металлов - это процесс, в результате которого металлы соединяются с кислородом, образуя оксиды. Окисление металлов может быть физическим или химическим явлением, в зависимости от причин, которые приводят к этому процессу.
Физическое окисление металлов происходит при взаимодействии металла с кислородом в атмосфере. При этом на поверхности металла образуется оксидная пленка. Примером физического окисления может служить окисление железа, при котором на поверхности металла образуется ржавчина.
Химическое окисление металлов, в свою очередь, происходит при взаимодействии металла с химическими реагентами. При этом окислительные вещества вступают в реакцию с металлом, что приводит к образованию новых соединений. Примером химического окисления может служить растворение цинка в серной кислоте, при котором происходит образование гидрогенсульфида цинка.
При физическом окислении металлы образуют тонкую пленку оксида, которая может обеспечивать защиту от дальнейшего окисления. В случае химического окисления, реакция может протекать более активно и может приводить к образованию различных соединений с окислителями.
Механизм окисления металлов

Окисление металлов - это химический процесс, который происходит при взаимодействии металла с кислородом воздуха или с другим окислителем. Этот процесс вызывает изменение состояния металла и приводит к образованию оксидов металла.
Механизм окисления металлов включает несколько этапов. Первым этапом является адсорбция кислорода на поверхности металла. Кислородные молекулы проникают в поверхностные слои металла и взаимодействуют с его атомами. В процессе окисления образуется оксид металла, который может быть дальше перенесен на поверхность металла или оставаться на ней в виде пленки.
Для некоторых металлов, таких как алюминий или цинк, механизм окисления включает образование прочной защитной пленки, которая предотвращает дальнейшее окисление металла. Напротив, для некоторых других металлов, таких как железо, окисление приводит к образованию нестабильной оксидной пленки, которая может разрушаться и обнажать новые поверхности металла для окисления.
Окисление металлов может быть ускорено факторами, такими как высокая температура, наличие влаги или наличие кислот или других агрессивных окружающих сред. Также существуют различные методы защиты металлов от окисления, такие как покрытие металла защитными пленками или использование специальных антикоррозийных веществ, которые помогают предотвратить процесс окисления.
Физические проявления окисления

Окисление металлов является сложным и многогранным процессом, который сопровождается физическими изменениями в структуре металла. Одним из физических проявлений окисления является образование окисной пленки на поверхности металла.
Окисная пленка образуется в результате взаимодействия металла с кислородом воздуха и окружающей среды. Она может быть разной толщины и цвета в зависимости от типа металла и условий окисления.
Другим физическим проявлением окисления является изменение цвета металла. Например, медь при окислении приобретает зеленоватый оттенок, железо — ржавчину, алюминий — серую патину. Это связано с образованием новых соединений на поверхности металла.
Также физическим проявлением окисления металлов может быть изменение физических свойств материала. Например, окисление железа приводит к увеличению его объема и образованию трещин на поверхности. Это может привести к утрате прочности и механическим повреждениям металла.
Химические реакции окисления
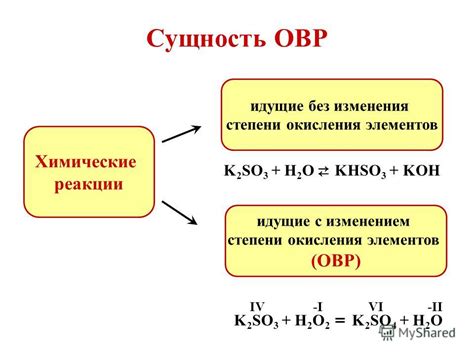
Окисление – это процесс, в ходе которого атомы одной или нескольких веществ передают электроны другому веществу. Окисление может происходить как с металлами, так и с неметаллами. В химических реакциях окисления важную роль играют окислитель и восстановитель. Окислитель – вещество, принимающее электроны, а восстановитель – вещество, отдающее электроны.
В окислительно-восстановительных реакциях важное значение имеют степени окисления элементов. Степень окисления – это численное значение, указывающее на изменение заряда атома в химическом соединении. В процессе окисления степень окисления увеличивается, а в процессе восстановления она уменьшается.
Одной из наиболее известных химических реакций окисления является реакция между металлом и кислородом. Например, при окислении железа образуется ржавчина – оксид железа(III). Реакция между алюминием и кислородом воздуха приводит к образованию оксида алюминия.
Другим примером химической реакции окисления является реакция атома металла с кислотой. Например, окисление цинка в кислоте приводит к образованию соли цинка и выделению водорода. Также, окисление металлов может происходить при контакте с веществами, содержащими электроотрицательные атомы, такими как хлор, фтор или сера.
Окисление металлов – это химический процесс, который приводит к изменению состояния и свойств металла путем передачи электронов. Химические реакции окисления играют важную роль в промышленности и в повседневной жизни человека.
Свойства окисленных металлов
1. Потеря металлического блеска: После окисления металлы теряют свой характерный блеск, становясь матовыми или даже покрываются патиной.
2. Образование оксидных пленок: Металлическая поверхность окисляется воздухом или водой, что приводит к образованию оксидных пленок, которые способны защищать металл от продолжительного окисления.
3. Изменение электропроводности: Окисленные металлы обычно имеют более низкую электропроводность, поскольку образование оксидной пленки мешает свободному движению электронов.
4. Увеличение массы: Из-за образования оксидной пленки, металлы могут набирать в массе, что может привести к деформации или потере своих исходных свойств.
5. Изменение химической активности: Окисленные металлы обычно имеют более низкую химическую активность, поскольку они уже насыщены кислородом из оксидных пленок.
6. Снижение стойкости к коррозии: Окисленные металлы становятся более подвержены коррозии и разрушению в результате воздействия окружающих сред, таких как кислород, вода или химически активные вещества.
Поверхностные изменения при окислении

Окисление металлов вызывает ряд поверхностных изменений, которые влияют на их свойства и внешний вид. Наиболее заметным следствием окисления является образование оксидной пленки на поверхности металла. Эта пленка обычно имеет темную или цветную окраску и может быть толщиной от нескольких микрометров до сотен микрометров.
Окислительное окружение способствует активному образованию оксидных пленок на поверхности металла. Эти пленки могут быть либо прочными и защищать металл от дальнейшего окисления, либо непрочными и приводить к дальнейшему разрушению металла.
- Масштабирование - одно из наиболее заметных последствий окисления металлов, когда на их поверхности образуются массы оксидной пленки, приводящие к отслаиванию слоев металла.
- Коррозия - химическое разрушение металла при взаимодействии с окружающей средой. В результате этого процесса на поверхности металла образуются ямки, трещины и другие поверхностные дефекты.
- Пигментация - изменение цвета металла в результате образования оксидной пленки. Некоторые металлы, такие как медь или железо, при окислении приобретают заметное изменение цвета, что может быть использовано в декоративных целях.
Поверхностные изменения при окислении металлов играют важную роль не только в понимании процесса окисления, но и в техническом и художественном применении металлов. Они могут влиять на прочность, стойкость к коррозии и эстетические свойства металлических изделий.
Влияние окружающей среды на окисление

Окружающая среда играет важную роль в процессе окисления металлов. Естественный воздух содержит кислород, который является одним из основных веществ, участвующих в окислительных реакциях. При взаимодействии с металлом кислород может приводить к его окислению. Также влияние на окисление металлов оказывает влажность воздуха.
Вода и влажность являются мощными окислителями для многих металлов. При наличии влаги образуются электролиты, которые способствуют электрохимическим реакциям. Например, вода может катализировать окисление железа и образование ржавчины. Также влага может способствовать коррозии алюминия и других металлов.
Оксиды металлов могут образовываться не только на воздухе, но и в водной среде. Некоторые металлы, например, цинк или алюминий, могут образовывать защитные оксидные пленки, которые предотвращают дальнейшее окисление. Однако, в некоторых условиях (например, при наличии солей или кислот) эти пленки могут разрушаться и начинаться активное окисление металла.
Таким образом, окружающая среда имеет большое влияние на процесс окисления металлов. Влажность, наличие кислорода и других окислителей, а также условия окружающей среды могут приводить к активному окислению металлов, образованию оксидов и ржавчины, что ведет к их разрушению и потере свойств.
Воздействие температуры на окисление
Температура является одним из факторов, который оказывает влияние на процесс окисления металлов. При повышении температуры, скорость реакции окисления увеличивается. Это связано с тем, что при более высокой температуре частицы металла обладают большей кинетической энергией и сталкиваются с молекулами кислорода более активно.
Также, повышение температуры способствует увеличению скорости диффузии кислорода внутрь металла. При более высокой температуре, межатомные расстояния в металле увеличиваются, что позволяет молекулам кислорода проникать вглубь металла быстрее.
С другой стороны, высокая температура может привести к обратной реакции - восстановлению окислов металла. Это происходит, когда внешняя среда обладает сильным восстановительным потенциалом и может быть сама по себе источником энергии для восстановления металла.
Температура воздействие на окисление металлов носит комплексный характер. Ее значение зависит от конкретного металла, его окислительного потенциала и окружающей среды. Для каждого металла существует определенный диапазон температур, при которых скорость окисления максимальна.
Защитные меры от окисления

Окисление металлов является химическим процессом, в результате которого металлы взаимодействуют с кислородом из воздуха или воды и превращаются в оксиды. Окисление металлов приводит к образованию ржавчины, потере блеска и прочности, а в некоторых случаях - к полной деградации материала.
Чтобы защитить металлы от окисления, применяются различные меры. Одним из эффективных способов является нанесение защитных покрытий на металлическую поверхность. Такие покрытия создают преграду между металлом и окружающей средой, предотвращая контакт с влагой и кислородом. Наиболее распространенными видами защитных покрытий являются краска, лак или полимерные пленки.
Другим способом защиты металлов от окисления является использование антикоррозионных добавок. Эти вещества добавляются в состав материала или применяются при обработке металлической поверхности. Антикоррозионные добавки обладают способностью связывать кислород или создавать защитные пленки на поверхности металла, предотвращая его окисление.
Важным фактором для защиты металлов от окисления является правильное хранение и транспортировка. Металлы должны храниться в сухом месте с низкой влажностью и защищены от прямого контакта с влагой или кислородом. Для транспортировки металлических изделий используются специальные упаковочные материалы, предотвращающие их взаимодействие с окружающей средой.
Также можно применять электрохимические методы защиты от окисления, такие как катодная защита. При этом на металлическую поверхность наносятся специальные анодные напыления или проводится электролитическая обработка, что позволяет подавать ток и защищать металл от окисления путем превращения его в катодную область.
Вопрос-ответ

Какие факторы влияют на скорость окисления металлов?
Скорость окисления металлов зависит от таких факторов, как температура окружающей среды, влажность, наличие кислорода и других окислителей, вида металла и его поверхностной обработки.
Можно ли предотвратить окисление металлов?
Да, окисление металлов можно предотвратить различными способами. Например, можно нанести на металлическую поверхность слой защитной краски или лака, что помешает проникновению влаги и кислорода. Также можно использовать методы антикоррозионной обработки, например, гальваническое покрытие металла другим металлом.
Может ли окисление металла привести к его разрушению?
Да, окисление металла может привести к его разрушению. При окислительной реакции образуются оксиды металла, которые могут быть пористыми и слабыми. Это может привести к образованию трещин и разрушению структуры металла. Кроме того, окисление может приводить к образованию коррозии, которая также разрушает металлические конструкции.
