Металлы 1 группы главной подгруппы периодической системы химических элементов относятся к самым активным веществам. В состоянии элемента щелочные металлы обладают мягкостью, низкой температурой плавления и высокой реактивностью. Главной особенностью щелочных металлов является наличие одной валентной электронной оболочки.
Самыми известными представителями щелочных металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). В своей естественной форме они образуют мягкие, серебристые металлы, которые легко реагируют с водой и кислородом. Химические свойства щелочных металлов определяются их высокой активностью и способностью образовывать легковоспламеняющиеся соединения.
Щелочные металлы часто используются в различных отраслях промышленности и науке. Одним из самых распространенных применений щелочных металлов является их использование в батареях, взрывных устройствах, фотоэлементах и солнечных батареях. Также из щелочных металлов производят сплавы, которые используются при производстве специальных сталей и легких сплавов.
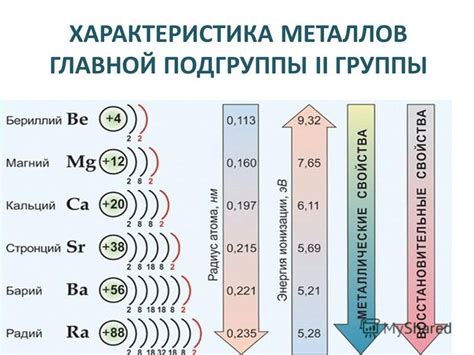
Щелочноземельные металлы, в свою очередь, отличаются от щелочных элементов своими химическими свойствами и местоположением в периодической системе. Они находятся во 2 группе и обладают двумя валентными электронными оболочками. К главным представителям щелочноземельных металлов относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba).
Щелочноземельные металлы обладают более высокой температурой плавления и большей плотностью по сравнению с щелочными металлами. Они являются относительно активными элементами и тоже способны реагировать с водой и кислородом. Химические соединения щелочноземельных металлов имеют широкое применение в производстве стекла, цемента, удобрений и лекарственных препаратов.
Металлы 1 группы главной подгруппы
Металлы 1 группы главной подгруппы относятся к щелочным и щелочноземельным галогенам. В эту группу входят такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Щелочные и щелочноземельные металлы имеют ряд общих свойств, характерных для всех элементов этой группы. Одним из таких свойств является высокая реактивность. Эти металлы легко реагируют с водой, выделяясь водородом и образуя гидроксиды.
Важной характеристикой щелочных и щелочноземельных металлов является низкая плотность. Например, литий, который является наименее плотным металлом, имеет плотность всего 0,53 г/см³.
Еще одним важным свойством данных металлов является низкая температура плавления. Например, у натрия температура плавления составляет всего 97,79 °C, а у калия - 63,5 °C. Это позволяет легко плавить эти металлы даже при относительно низких температурах.
В целом, металлы 1 группы главной подгруппы являются весьма интересными и уникальными элементами. Их свойства и реактивность делают их важными компонентами в различных химических и промышленных процессах, а также в бытовой жизни.
Щелочные галогены
Щелочные галогены – это элементы, которые относятся к первой группе главной подгруппы периодической системы. Они включают в себя элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают уникальными химическими и физическими свойствами.
Щелочные галогены обладают высокой химической активностью и легко образуют ионные связи. Они имеют одну внешнюю электронную оболочку, содержащую одну электронную-parity, которая легко отдают в химических реакциях. Их химические реактивности приводит к образованию оксиано-и сульфо-соединений, что делает их полезными в различных областях, таких как производство стекла и керамики, фармацевтическая и химическая промышленность, и даже сельское хозяйство.
Одно из самых характерных свойств щелочных галогенов - их способность к образованию солей. Они реагируют с металлическими элементами, образуя ионные соединения. Например, щелочные галогены реагируют с щелочно-земельными металлами, образуя соли, такие как хлориды, бромиды и йодиды.
Щелочные галогены широко используются в различных сферах науки и технологии. Литий, например, используется в аккумуляторах и в производстве лекарств. Натрий входит в состав многих продуктов питания и используется в производстве щелочей и пластмасс. Калий используется в сельском хозяйстве для подкормки растений, а также в производстве удобрений и калийных соединений.
Свойства щелочных галогенов

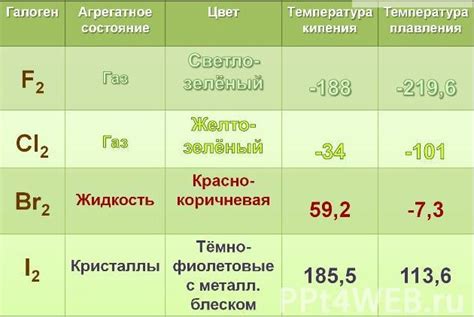
Щелочные галогены - это элементы первой группы (I группа) главной подгруппы периодической системы, состоящая из фтора (F), хлора (Cl), брома (Br), йода (I) и астатина (At). Они характеризуются рядом уникальных свойств, которые делают их важными для различных областей науки и промышленности.
1. Высокая реактивность: Щелочные галогены являются очень реактивными элементами. Они легко вступают в соединение с другими элементами, образуя сильные химические связи. Например, они образуют соли с металлами, такие как натрий или калий.
2. Отрицательные окислительные свойства: Щелочные галогены обладают сильными окислительными свойствами. Они могут отбирать электроны у других веществ, что делает их мощными окислителями. Это свойство позволяет им использоваться в различных реакциях окисления и в процессе очистки воды.
3. Высокая химическая активность: Из-за своей высокой химической активности щелочные галогены часто используются в лабораторных и промышленных процессах. Они широко применяются в производстве лекарств, пластмасс, фотопленок и других химических соединений.
4. Повышенная электронегативность: Щелочные галогены имеют высокую электроотрицательность, что означает, что они привлекают электроны во время химических реакций. Это свойство делает их важными компонентами в электрохимических процессах, антисептиках и других применениях.
В целом, щелочные галогены обладают уникальными свойствами, которые делают их неотъемлемой частью многих научных и технических областей. Их химическая активность и окислительные свойства делают их полезными инструментами для исследования и разработки новых материалов и соединений.
Названия щелочных галогенов

Первая группа главной подгруппы периодической системы элементов включает в себя щелочные галогены. Щелочные галогены включают элементы первой группы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Названия щелочных галогенов обусловлены их химическими свойствами и происхождением. Например, название элемента литий произошло от греческого слова "lithos", что означает "камень", так как литий обнаруживается в горных породах. Название натрий произошло от слова "natrium", которое было использовано древними египтянами для обозначения соды.
Калий получил свое название от слова "kalium", которое в переводе означает "калиевая соль". Рубидий был назван так в честь светофорного камня, который имеет красный цвет, а цезий был назван в честь скайских слов "цизий" или "цаис", означающих "синий". Франций получил свое название в честь Франции, где был открыт.
Таким образом, названия щелочных галогенов отражают их происхождение и основные химические свойства, что помогает идентифицировать и классифицировать эти элементы в периодической системе.
Щелочноземельные галогены
Щелочноземельные галогены, также известные как вторая группа главной подгруппы, включают металлы кальция, стронция, бария и радия. Они являются элементами д-блока периодической системы и химически активными.
Кальций является наиболее распространенным из этих металлов и широко используется в различных отраслях промышленности. Он обладает мягким серебристым оттенком и химически активен, что делает его полезным для производства сплавов, цемента и других материалов.
Стронций технический используется в производстве электронных устройств, оптики, пиротехники и ядерной энергетики. Барий, как сильный поглотитель рентгеновских лучей, широко применяется в медицине для диагностики и исследований костей и органов.
Радий является радиоактивным элементом и имеет высокую активность. Он использовался в прошлом в медицине для лечения рака, однако из-за его высокой токсичности и радиоактивности, сейчас его применение ограничено.
- Кальций
- Стронций
- Барий
- Радий
Обобщая, щелочноземельные галогены представляют вторую группу главной подгруппы металлов и включают кальций, стронций, барий и радий. Они обладают различными химическими и физическими свойствами, и широко применяются в различных отраслях промышленности и науки.
Свойства щелочноземельных галогенов

Щелочноземельные галогены – это элементы, относящиеся к 2 главной группе Периодической системы элементов. В эту группу входят бериллий, магний, кальций, стронций, барий и радий. Они обладают схожими свойствами и образуют соли, а также проявляют галогенное поведение, характерное для 7 группы.
Щелочноземельные галогены имеют два электрона в валентной оболочке, что делает их химически активными. Они образуют ионные соединения с элементами группы 6. Вместе они образуют соли, известные как галогениды. Например, бериллий может образовывать галогениды с хлором, бромом или йодом.
Одним из главных свойств щелочноземельных галогенов является их сильная реактивность. Они могут вызывать ожоги и раздражение на коже и слизистых оболочках. Кроме того, они могут быть ядовитыми при попадании в организм.
- Бериллий - это легкий и прочный металл, который используется в производстве сплавов, керамики и ядерных реакторов. Он имеет высокую теплопроводность и устойчив к коррозии.
- Магний - это легкий и огнеупорный металл, используемый в производстве сплавов, автомобильных деталей, противопригарных кастрюль и анодов аккумуляторов. Он также является важным элементом в органике и витальным для многих живых организмов.
- Кальций - это щелочноземельный металл, важный для роста и развития растений и животных. Он используется в производстве стекла, цемента, стали и многих других продуктов. Кальций также является необходимым элементом питания для человека.
- Стронций - это мягкий и серебристый металл, используемый в производстве пиротехнических материалов и ядерных реакторов. Он также может быть использован для анализа костной ткани и в медицинских приборах.
- Барий - это плотный и серебристый металл, используемый в производстве светонепроницаемого стекла, рентгеновских лучей и взрывчатых веществ. Он также может быть использован в металлургии и катализаторах.
- Радий - это радиоактивный металл, который найти можно только в крайне малых количествах в земной коре. Он используется в медицине для лечения рака и в научных исследованиях.
Таким образом, щелочноземельные галогены обладают уникальными свойствами и находят применение в различных отраслях промышленности и науки.
Названия щелочноземельных галогенов
Щелочноземельные галогены — это химические элементы из второй группы периодической системы, а именно: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название благодаря своей химической природе и сходству с галогенами.
Щелочноземельные галогены обладают следующими свойствами:
- Являются металлами соответствующей группы.
- Образуют соединения с элементами из галогенной группы (фтор, хлор, бром, йод).
- Являются реактивными элементами с высокой электроотрицательностью.
- Образуют сильные щелочной оксиды с кислородом.
- Имеют низкую плотность и плавятся при высоких температурах.
Каждый элемент щелочноземельных галогенов имеет свои особенности:
- Бериллий (Be) - имеет наименьшую плотность среди всех щелочноземельных галогенов и высокую температуру плавления.
- Магний (Mg) - обладает высокой теплопроводностью и применяется в легких сплавах и в производстве огнеупорных материалов.
- Кальций (Ca) - широко используется в строительстве и в производстве стали.
- Стронций (Sr) - используется в производстве пиротехнических и радиолюминесцентных материалов.
- Барий (Ba) - применяется в производстве кабельных конструкций и стекла для рентгеновской оптики.
- Радий (Ra) - является радиоактивным элементом и обладает высокой токсичностью.
Названия щелочноземельных галогенов происходят от их химической природы и являются частью общепринятой номенклатуры химических элементов.
Вопрос-ответ

Какие металлы относятся к первой группе главной подгруппы?
К первой группе главной подгруппы относятся следующие металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs).
Какие свойства обладают металлы первой группы главной подгруппы?
Металлы первой группы главной подгруппы, такие как литий, натрий, калий и др., обладают следующими свойствами: низкая плотность, низкая температура плавления и кипения, высокая химическая реактивность, легкая окисляемость.
Каково название химической группы, к которой относятся металлы первой группы главной подгруппы?
Металлы первой группы главной подгруппы относятся к группе щелочных металлов. Они называются так, потому что они образуют щелочные (основные) оксиды и гидроксиды при реакции с водой.
