Соединения галогенов с ионами щелочных металлов являются одной из самых изучаемых групп неорганических соединений. Галогены (фтор, хлор, бром, йод) и щелочные металлы (литий, натрий, калий, рубидий, цезий) обладают уникальными свойствами, которые делают их соединения особенно интересными для исследования.
Главным свойством соединений галогенов с ионами щелочных металлов является их химическая активность. Галогены, будучи сильными окислителями, способны взаимодействовать с щелочными металлами, образуя стабильные ионные соединения. Этот процесс сопровождается выделением большого количества энергии в виде тепла и света.
Соединения галогенов с ионами щелочных металлов обладают также высокой электротекучестью и отличными проводящими свойствами. Их растворы обладают яркими окрасками, что делает их использование в качестве пигментов и красителей широко распространенным. Кроме того, эти соединения широко применяются в производстве фоточувствительных материалов, ламп накаливания и других электронных устройств.
Изучение соединений галогенов с ионами щелочных металлов имеет большое значение не только для фундаментальной науки, но и для различных технических и промышленных областей. Благодаря своим уникальным свойствам, эти соединения нашли широкое применение в различных отраслях, от химической промышленности до электроники.
Соединения галогенов с ионами щелочных металлов: основные характеристики и свойства
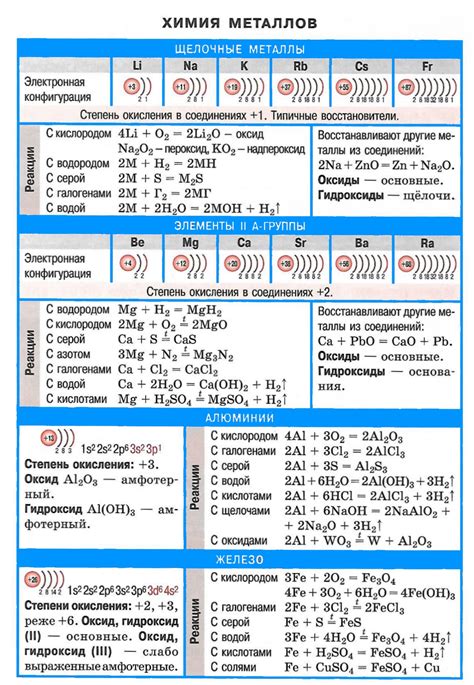
Соединения галогенов с ионами щелочных металлов являются важными веществами в химии и имеют ряд характеристик и свойств, которые определяют их использование в различных областях.
Одним из основных свойств соединений галогенов с ионами щелочных металлов является их солевой характер. В результате реакции галогена с щелочным металлом образуется соль, которая является ионным соединением. Это объясняется высокой электроотрицательностью галогенов и электроположительностью ионов щелочных металлов.
Другим важным свойством соединений галогенов с ионами щелочных металлов является их растворимость в воде. Большинство этих соединений обладает высокой степенью растворимости, что делает их удобными для использования в различных процессах, включая промышленность и научные исследования.
Помимо этого, соединения галогенов с ионами щелочных металлов обладают высокой степенью активности и химической реакционности. Это свойство объясняется тем, что галогены обладают высокой электроотрицательностью и стремятся к получению электронов, в то время как ионы щелочных металлов имеют низкую электронную плотность и легко отдают электроны.
Соединения галогенов с ионами щелочных металлов также характеризуются высокой температурой плавления и кипения. Это свойство объясняется сильными межатомными связями в их структуре, которые требуют большого количества энергии для разрыва вещества.
Некоторые соединения галогенов с ионами щелочных металлов могут обладать также и другими особыми свойствами, такими как флуоресценция или антисептическое действие. Они могут быть использованы в различных областях, включая производство светоизлучающих диодов и антисептических средств для медицины и гигиены.
Взаимодействие галогенов и ионов щелочных металлов

Одна из наиболее распространенных химических реакций, связывающих галогены и ионы щелочных металлов, это образование солей. Галогены, такие как фтор, хлор, бром и йод, способны образовывать стабильные соединения с ионами щелочных металлов, такими как натрий, калий и цезий.
При взаимодействии галогена и иона щелочного металла образуется ионная связь, где ион галогена притягивается к иону щелочного металла с помощью электростатической силы. Ионы галогена обладают отрицательным зарядом, а ионы щелочного металла - положительным зарядом. Это приводит к образованию кристаллической решетки соединения.
Соединения галогенов с ионами щелочных металлов обладают рядом характеристик и свойств. Они обычно обладают высокой степенью растворимости в воде и могут образовывать кристаллические отложения при испарении растворов. Они также обычно весьма реактивны и могут претерпевать химические превращения при взаимодействии с другими веществами.
Важно отметить, что характеристики и свойства соединений галогенов с ионами щелочных металлов зависят от конкретных галогенов и щелочных металлов, а также от условий реакции. Например, соединение галогена с натрием может иметь отличающиеся свойства по сравнению со соединением галогена с калием.
Основные характеристики соединений галогенов и ионов щелочных металлов
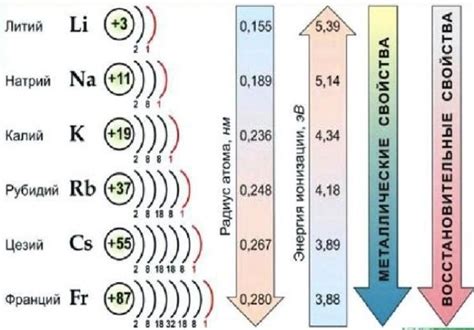
1. Реактивность и структура: Соединения галогенов и ионов щелочных металлов характеризуются высокой реактивностью и способностью образовывать ионные соединения. Галогены (фтор, хлор, бром, йод) обладают высокой электроотрицательностью, что позволяет им образовывать ионы отрицательного заряда. Ионы щелочных металлов (литий, натрий, калий, рубидий, цезий) имеют положительный заряд, что способствует образованию стабильных ионных связей.
2. Растворимость: Большинство соединений галогенов и ионов щелочных металлов обладают высокой растворимостью в воде. Ионы галогенов образуют ионы гидроксидов с ионами щелочных металлов, что способствует диссоциации в водных растворах. Это делает эти соединения широко используемыми в химической и фармацевтической промышленности.
3. Физические свойства: Соединения галогенов и ионов щелочных металлов обладают различными физическими свойствами. Например, галогены в свободной форме представляют собой газы (фтор и хлор) или низкотемпературные жидкости (бром и йод). Соединения галогенов с ионами щелочных металлов могут быть как кристаллическими соединениями, так и жидкими или газообразными в зависимости от условий окружающей среды.
4. Использование: Соединения галогенов и ионов щелочных металлов находят широкое применение в различных отраслях науки и промышленности. Например, ионные соединения галогенов и щелочных металлов используются в производстве солей, катализаторов, пищевых добавок и многих других химических соединений. Кроме того, некоторые соединения этого типа могут быть использованы в медицине для лечения различных заболеваний и инфекций.
Свойства соединений галогенов с ионами щелочных металлов

1. Растворимость: Соединения галогенов с ионами щелочных металлов обычно хорошо растворяются в воде. Это связано с высокой полярностью этих соединений, а также с образованием ионов в растворе. Растворы обладают характеристической цветностью, которая зависит от конкретного галогена и щелочного металла.
2. Кристаллическая структура: Соединения галогенов с ионами щелочных металлов обычно образуют кристаллические структуры. Эти структуры могут быть различных типов, включая ионные, ковалентные и металлические. Кристаллические структуры влияют на свойства соединений, такие как температура плавления и твердость.
3. Химическая активность: Соединения галогенов с ионами щелочных металлов обладают высокой химической активностью. Галогены имеют высокую электроотрицательность, что позволяет им образовывать стабильные анионы. Щелочные металлы, в свою очередь, обладают низкой электроотрицательностью, что способствует образованию стабильных катионов. Это позволяет соединениям проявлять активность как окислителей, так и восстановителей.
4. Физические свойства: Соединения галогенов с ионами щелочных металлов обладают определенными физическими свойствами. Например, они могут быть твердыми веществами при комнатной температуре, с высокой плотностью и твердостью. Некоторые из них обладают кристаллическими структурами, которые влияют на их механические свойства, такие как твердость и ломкость.
Вопрос-ответ

Какие галогены образуют соединения с ионами щелочных металлов?
По химической активности к галогенам относятся хлор (Cl), бром (Br) и иод (I). Эти галогены могут образовывать соединения с ионами щелочных металлов.
Какова основная характеристика соединений галогенов с ионами щелочных металлов?
Соединения галогенов с ионами щелочных металлов обладают сольными свойствами. Они образуют кристаллические структуры, растворяются в воде и имеют высокую температуру плавления и кипения.
Какие свойства обусловлены образованием соединений галогенов с ионами щелочных металлов?
Соединения галогенов с ионами щелочных металлов обычно обладают сильной отчетливой окраской, высокой степенью растворимости и хорошим растворимым мостом. Они могут использоваться в различных промышленных и научных областях.
