Оксиды двухвалентных металлов - это химические соединения, состоящие из атомов металла и кислорода. Они представляют собой одну из наиболее распространенных классов оксидов, которые играют важную роль в различных областях химии и промышленности.
В общем виде формула оксидов двухвалентных металлов имеет вид MnOm, где M обозначает металл, а n и m - целые числа, показывающие соотношение атомов металла и кислорода в соединении. В большинстве случаев, оксиды двухвалентных металлов имеют кристаллическую структуру и образуют ионные связи.
Оксиды двухвалентных металлов могут быть как основаниями, так и кислотами. Это свойство обусловлено способностью двухвалентных ионов металла как принимать, так и отдавать электроны. Кроме того, оксиды двухвалентных металлов обладают различными химическими и физическими свойствами, включая растворимость в воде, температуру плавления и жаростойкость.
Формула оксидов двухвалентных металлов

Оксиды двухвалентных металлов являются важными соединениями, которые имеют широкое применение в различных областях науки и техники. Формула таких оксидов обычно представляет собой комбинацию символов металла и кислорода.
Общая формула оксидов двухвалентных металлов имеет вид MO, где M обозначает символ металла, а O - символ кислорода. Например, оксид железа (II) имеет формулу FeO, где Fe - символ железа.
Среди оксидов двухвалентных металлов можно выделить несколько типов. Некоторые из них имеют ионную структуру, где кислород образует отрицательные ионы O2-. Примером такого оксида является оксид меди (II) с формулой CuO.
Другие оксиды двухвалентных металлов могут иметь ковалентную структуру, где кислород образует ковалентные связи с металлом. Примером такого оксида является оксид свинца (II) с формулой PbO.
Формула оксидов двухвалентных металлов позволяет определить соотношение между атомами металла и кислорода в соединении. Она играет важную роль при проведении химических реакций и исследовании свойств оксидов металлов. Знание формул оксидов является основой для понимания и изучения химии двухвалентных металлов.
Свойства и состав оксидов

Оксиды двухвалентных металлов представляют собой химические соединения, состоящие из металлического и кислородного атомов. Они обладают рядом уникальных свойств, которые определяют их важную роль в различных областях науки и промышленности.
Одно из основных свойств оксидов - их способность образовывать соли. Это связано с тем, что металлическая часть оксида имеет положительный заряд, который может образовывать ионные связи с отрицательно заряженными атомами других элементов. Таким образом, оксиды играют важную роль в химических реакциях, таких как нейтрализация, окисление и редукция.
Оксиды также обладают высокой термической стабильностью, что делает их полезными как материалы для высокотемпературных приложений. Они могут выдерживать экстремальные температуры без разложения или изменения своих свойств. Это делает они идеальными для использования в производстве керамики, стекла, электроизоляционных материалов и других огнеупорных изделий.
Другим важным свойством оксидов является их химическая инертность. Они мало реактивны с другими веществами, что делает их стабильными и неподверженными окислительным или восстановительным реакциям. Это позволяет использовать оксиды как защитные покрытия для металлических поверхностей, которые не должны контактировать с воздухом или другими химическими веществами.
Оксиды двухвалентных металлов также могут иметь различные структуры и фазовые переходы при изменении температуры и давления. Некоторые оксиды могут образовывать кристаллические структуры, которые обладают определенной регулярностью и могут иметь специфические механические, электрические и оптические свойства.
Изучение свойств и состава оксидов двухвалентных металлов является важной задачей в химической науке. Это позволяет не только расширить наше понимание химических процессов и реакций, но и разработать новые материалы и технологии с использованием этих соединений.
Применение оксидов двухвалентных металлов
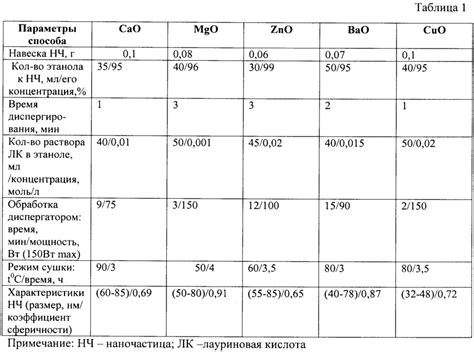
Оксиды двухвалентных металлов широко применяются в различных отраслях промышленности и научных исследованиях. Эти соединения обладают рядом уникальных свойств, которые позволяют использовать их в разнообразных приложениях.
Оксиды двухвалентных металлов являются химическими соединениями, состоящими из иона металла и кислородного иона. Они обладают высокой термической и химической стабильностью, что делает их приметными в материаловедении и каталитических процессах. Например, оксид меди (CuO) используется в производстве проводников, керамики и катализаторов.
Оксиды двухвалентных металлов также применяются в электронике и оптике. Оксид цинка (ZnO) используется в изготовлении светодиодов, солнечных панелей и транзисторов. Благодаря своим полупроводниковым свойствам, оксиды металлов находят применение в создании электронных компонентов и устройств.
Другим важным применением оксидов двухвалентных металлов является использование их в каталитических процессах. Оксиды металлов, такие как оксид железа, оксид никеля и оксид кобальта, являются активными катализаторами в различных реакциях. Катализаторы на основе оксидов металлов используются в производстве пластмасс, промышленности пищевых продуктов и нефтехимии.
Кроме того, оксиды двухвалентных металлов широко применяются в медицине и фармацевтической промышленности. Они используются для создания препаратов, лекарственных препаратов и добавок к пище. Например, оксид цинка широко используется в косметических средствах, таких как солнцезащитные кремы и пудра.
В заключение, оксиды двухвалентных металлов играют важную роль в различных сферах человеческой деятельности. Благодаря своим уникальным свойствам, они находят применение в материаловедении, электронике, катализе, медицине и других отраслях промышленности.
Вопрос-ответ

Что такое оксиды двухвалентных металлов?
Оксиды двухвалентных металлов - это соединения, состоящие из металла и кислорода, в которых металл имеет валентность два.
Какую роль играет валентность металла в оксидах?
Валентность металла в оксидах определяет количество электронов, которые металл отдает, чтобы образовать ион металла с положительным зарядом. В случае двухвалентных металлов, валентность составляет два.
Какова общая формула оксидов двухвалентных металлов?
Общая формула оксидов двухвалентных металлов - M2O, где M представляет собой символ металла.
Какие металлы относятся к двухвалентным?
К двухвалентным металлам относятся металлы, которые имеют возможность образовывать ионы со зарядом плюс два. Некоторые примеры таких металлов: железо (Fe), медь (Cu), марганец (Mn) и цинк (Zn), а также многие другие.
