Металлы проявляют различную реактивность при взаимодействии с растворами кислот. Это связано с их химическими свойствами и электрохимической активностью. Такое взаимодействие может быть как спонтанным, так и затрудненным в зависимости от характера кислоты и металла.
Одним из наиболее ярких примеров реакции металла с кислотой является взаимодействие цинка с соляной кислотой. При этом образуется соль и выделяется водородный газ. Реакция протекает с выделением тепла и характеризуется быстрым темпом. Подобные реакции обусловлены разностью электрохимического потенциала между металлом и водородом, что приводит к его окислению и образованию соответствующей соли.
Не все металлы способны взаимодействовать с кислотами таким образом. Например, алюминий и хром имеют низкую реактивность при контакте с соляной кислотой. Это связано с образованием на их поверхности плотной оксидной пленки, которая предотвращает дальнейшее проникновение кислоты. В таких случаях реакция может протекать лишь в присутствии добавок или при повышенных температурах.
Химические реакции металлов с кислотами
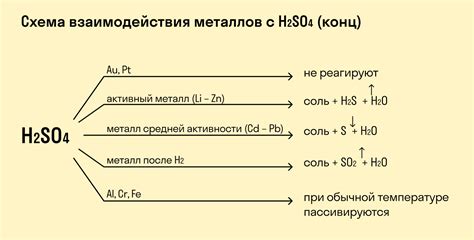
Химические реакции металлов с кислотами являются одним из основных типов реакций в химии. В результате взаимодействия металла и кислоты происходит образование соли и выделение газа – это процесс, называемый нейтрализацией.
Каждая металл имеет свой ряд активности, определяющий его способность реагировать с кислотами. Наиболее активные металлы, такие как натрий или калий, реагируют сильно и начинают гореть при контакте с кислотами. Менее активные металлы, например, железо или цинк, реагируют медленнее и не подвергаются горению.
Реакции металлов с кислотами могут протекать различными способами. Например, цинк взаимодействует с соляной кислотой, образуя хлорид цинка и выделяя водородный газ:
Zn + 2HCl → ZnCl2 + H2
Алюминий реагирует с серной кислотой, образуя алюминийсульфат и выделяя сернистый газ:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2S
Реакции металлов с кислотами могут быть полной или неполной, в зависимости от условий и концентрации используемых реагентов. В ходе реакции может происходить выделение тепла – это термическая реакция, которая может приводить к нагреву или закипанию раствора.
Важно отметить, что реакция металлов с кислотами является одной из основных причин коррозии металлических изделий в промышленности и быту. Поэтому при работе с кислотами необходимо соблюдать меры предосторожности и использовать соответствующие защитные средства.
Влияние кислотности на химическую реакцию

Кислотность среды является важным фактором, который влияет на протекание химических реакций. Она определяется концентрацией и активностью кислоты, в данном случае – раствора кислоты. Кислотность может быть выражена величиной pH, которая показывает концентрацию ионов водорода в растворе.
Уровень кислотности оказывает влияние на движение реакционного равновесия и скорость химической реакции. В нейтральной среде (pH = 7) ионизация кислоты и реакции, связанные с образованием или распадом ионов водорода, происходят наиболее медленно. При изменении кислотности в одну или другую сторону, скорость реакции может как возрасти, так и уменьшиться.
Изменение кислотности влияет на степень растворимости металлов в реакции с кислотами. Некоторые металлы могут активно реагировать только в кислотной среде, а в нейтральной или щелочной среде их активность может быть значительно снижена или реакция может вообще не протекать. Другие металлы, наоборот, растворяются лучше в нейтральной среде, а при добавлении кислоты их активность может уменьшиться.
Таким образом, кислотность раствора играет важную роль в химических реакциях металлов с кислотами. Это влияние проявляется не только на скорость реакции, но и на активность и растворимость металлов. Поэтому изучение взаимодействия металлов с растворами кислот требует учета и контроля кислотности среды.
Кислотные растворы как окислители металлов
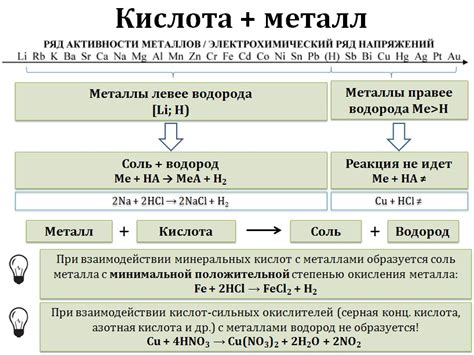
Кислотные растворы обладают свойством окислять металлы при их взаимодействии. Окисление металлов в кислотных растворах происходит за счет активного кислорода, образующегося в результате реакции металла с кислородом раствора.
Металлы могут реагировать с кислотами различными способами. Некоторые металлы, такие как цинк и алюминий, реагируют с кислотой, выделяя водород. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и молекулярный водород:
- Zn + 2HCl → ZnCl2 + H2
Другие металлы, такие как железо и медь, могут реагировать с кислотой, образуя соответствующие соли и выделяя диоксид серы или оксиды азота в виде газов. Например, соляная кислота реагирует с железом и образует хлорид железа и диоксид серы:
- Fe + 2HCl → FeCl2 + SO2
Некоторые металлы, такие как медь и серебро, не реагируют с обычными кислотами, такими как соляная кислота или серная кислота, но могут реагировать с более сильными оксидационными кислотами, такими как концентрированный азотная кислота. В результате такой реакции образуется соответствующая соль и выделяются оксиды азота:
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 4NO2 + 2H2O
Таким образом, кислотные растворы могут служить эффективными окислителями для различных металлов, что делает их важными компонентами в химических реакциях и технологических процессах.
Механизмы реакций металлов с кислотами

Взаимодействие металлов с кислотами является химическим процессом, происходящим на молекулярном уровне. Результирующие реакции зависят от особенностей металла и кислоты, а также условий окружающей среды.
Основными механизмами реакций металлов с кислотами являются окислительно-восстановительные реакции и протолитические реакции.
Окислительно-восстановительные реакции между металлом и кислотой заключаются в передаче электронов от металла к кислороду в молекуле кислоты. Металл окисляется, теряя электроны, а кислород восстанавливается. В результате образуется соль металла и вода.
Протолитические реакции предполагают образование водорода при взаимодействии металла с протоном кислоты. Металл выступает в качестве восстановителя, принимая протон и образуя молекулярный водород.
Взаимодействие металлов с кислотами может протекать с различной интенсивностью в зависимости от активности металлов и концентрации кислоты. Некоторые металлы, например, алюминий или цинк, реагируют с кислотами быстро и энергично, в то время как другие металлы, вроде золота или платины, практически не реагируют с кислотами.
Вопрос-ответ

Какие реакции происходят при взаимодействии металлов с кислотами?
Взаимодействие металлов с кислотами приводит к образованию солей и выделению водорода. При этом металл замещает водород в кислоте, образуя соль и выделяя газ.
Какие металлы реагируют с кислотами?
Реакция с кислотами может происходить с большинством металлов. Некоторые из наиболее активных металлов, такие как натрий, калий и магний, реагируют с кислотами очень быстро и образуют соли и водород. Другие металлы, такие как железо или цинк, могут реагировать медленнее, но тоже образуют соли и водород.
Какие особенности есть взаимодействия металлов с разными кислотами?
Одной из особенностей взаимодействия металлов с кислотами является реакция только с определенными видами кислот. Например, натрий реагирует только с кислотой соляной, а не с кислотой серной или уксусной. Другая особенность заключается в разной интенсивности реакции. Некоторые металлы реагируют очень активно, выделяя водород и образуя соли, а другие металлы могут реагировать медленнее и образовывать менее активные соли.
Какова роль водорода в реакции металлов с кислотами?
Водород играет важную роль в реакции металлов с кислотами. Когда металл реагирует с кислотой, он замещает водород, образуя соль и выделяя водородный газ. Водородный газ имеет свойство выделяться в виде пузырей, что является одним из признаков прохождения реакции между металлом и кислотой.
