Реакции неактивных металлов с кислотами представляют собой важный раздел химии, который исследует взаимодействие металлов с соединениями, обладающими кислотными свойствами. Неактивные металлы, такие как железо, медь, цинк и свинец, обладают низкой химической активностью, что делает их особенно интересными для изучения.
Основной закон химической реакции между неактивными металлами и кислотами – закон сохранения массы. Согласно этому закону, масса реагентов (металла и кислоты) должна быть равна массе продуктов реакции. Это означает, что при реакции металла с кислотой не происходит потери или прироста массы. Закон сохранения массы подтверждает, что реакция между неактивными металлами и кислотами происходит в строго определенном соотношении.
Кроме закона сохранения массы, для реакции неактивных металлов с кислотами характерны и другие законы химии. Например, закон эквивалентных пропорций устанавливает, что для любой реакции между металлом и кислотой существует определенное соотношение между количеством реагентов и продуктов. Это соотношение образуется на основе величины эквивалента реагента и позволяет определить точное количество продукта реакции.
Реакции неактивных металлов с кислотами имеют широкое применение в различных сферах науки и техники. На основе законов химии, связанных с этими реакциями, разрабатываются методы синтеза различных соединений, а также производство и использование различных материалов и веществ. Изучение реакций неактивных металлов с кислотами позволяет расширить наши знания о законах химии и способствует развитию научных исследований в данной области.
Химические взаимодействия между металлами и кислотами

Химические взаимодействия между металлами и кислотами являются одним из основных объектов изучения химии. При контакте металла с кислотой происходят разнообразные химические реакции, которые осуществляются в соответствии с законами химии.
В ходе этих реакций металлы могут проявлять свои разнообразные свойства. Некоторые металлы, такие как цинк, железо и алюминий, реагируют с кислотами активно и образуют соли и выделяются соответствующие газы (например, водород). Эти реакции часто сопровождаются выделением тепла и шипением.
Другие, менее активные металлы, такие как медь, серебро и золото, не реагируют с кислотами таким образом и образуют соли только в присутствии специальных окислителей.
Реакции между металлами и кислотами можно представить в виде уравнений. Например, реакция цинка с соляной кислотой может быть записана следующим образом: Zn + 2HCl -> ZnCl2 + H2. Здесь цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя молекулы водорода.
Эти реакции имеют практическое значение. Например, они используются в процессе производства водорода, который является важным компонентом в различных отраслях промышленности. Также, эти реакции входят в программу школьного курса химии и являются основой для понимания ряда химических процессов и законов химии.
Принципы реакции неактивных металлов с кислотами

Реакция неактивных металлов с кислотами является важной темой в химии. Неактивные металлы, такие как железо, цинк и алюминий, обладают свойством разрушать молекулы кислот и образовывать соли. Это происходит благодаря ионному обмену между металлом и кислотой.
Принцип реакции заключается в том, что неактивный металл вытесняет из кислоты менее активный металл. Например, цинк может вытеснить из раствора серную кислоту, образуя соль цинка и выделяя водород. Это объясняется тем, что цинк имеет большую активность, чем медь, элемент, содержащийся в серной кислоте.
Реакция неактивного металла с кислотой может быть представлена уравнением: металл + кислота → соль + водород. Например, реакция железа с соляной кислотой приводит к образованию соли железа(II) и выделению водорода.
Уравнения реакций с кислотами могут также заключать в себе реакции замещения. Например, алюминий может вытеснить из раствора медной кислоты ион меди, образуя алюминат меди(II) и выделяя водород.
Разряд активности металлов в ряду напряженности элементов позволяет определить, какой металл способен вытеснить другой из раствора кислоты. Неактивные металлы обычно вытесняют ионы менее активных металлов, что и является основой для понимания и объяснения реакций неактивных металлов с кислотами.
Уравнение реакции между металлами и кислотами
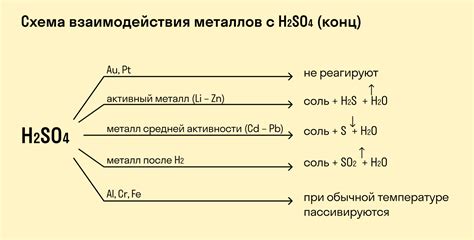
В химической реакции между металлом и кислотой происходит обмен ионами, при котором металл участвует в окислительно-восстановительном процессе. Результатом этой реакции являются соль и газ. Уравнение этой реакции можно записать в следующем виде:
M + HX → MX + H₂
- M - символ металла, участвующего в реакции;
- HX - кислота, с которой происходит реакция;
- MX - получается соль металла и кислоты;
- H₂ - образуется при реакции газ (водород).
Например, реакция между цинком и соляной кислотой может быть представлена следующим уравнением:
Zn + 2HCl → ZnCl₂ + H₂
Полученная соль цинка и соляной кислоты является хлоридом цинка, а газом, выделяющимся при реакции, является водород.
Степень активности металла определяет потенциал реакции. Так, реакция будет протекать только в случае, если металл будет активнее водорода. Например, медь не реагирует с соляной кислотой, так как она менее активна, чем водород.
Зная уравнение реакции между металлами и кислотами, можно определить продукты реакции и предсказать, какие вещества будут образовываться при данной химической реакции.
Закономерности взаимодействия неактивных металлов с кислотами

В химии существует ряд закономерностей, определяющих взаимодействие неактивных металлов с кислотами. Эти законы помогают понять, как происходит реакция между металлом и кислотой, и какие продукты образуются.
Первым законом является закон сохранения массы. Он утверждает, что масса реагирующих веществ равна массе образовавшихся продуктов. В контексте взаимодействия неактивных металлов с кислотами, это означает, что масса металла и кислоты, которые реагируют между собой, равна массе образовавшейся соли и выделившегося водорода.
Вторым законом является закон простой и кратной пропорциональности. Он утверждает, что масса продукта реакции пропорциональна количеству реагирующих веществ. В контексте взаимодействия неактивных металлов с кислотами, это означает, что масса образовавшейся соли будет зависеть от количества металла и кислоты, вступивших в реакцию.
Третьим законом является закон эквивалентных пропорций. Он утверждает, что взаимодействие металла и кислоты происходит в определенных пропорциях, при которых масса металла и кислоты соответствует их эквивалентным массам. Таким образом, можно рассчитать, сколько металла и кислоты необходимо для образования определенного количества соли.
Взаимодействия неактивных металлов с кислотами являются примером применения этих закономерностей. Они позволяют предсказать, какие продукты образуются при реакции, и определить оптимальные условия для получения нужной соли.
Вопрос-ответ

Какие металлы считаются неактивными?
Неактивными металлами считаются такие металлы, которые плохо реагируют с кислотами. К ним относятся медь, серебро, свинец и золото.
Какие законы химии описывают реакцию неактивных металлов с кислотами?
Реакция неактивных металлов с кислотами описывается такими законами химии, как закон сохранения массы, закон сохранения заряда и закон пропорций.
Какие вещества образуются в результате реакции неактивных металлов с кислотами?
При реакции неактивных металлов с кислотами образуются соли и выделяется водород. Например, при реакции меди с соляной кислотой образуется хлорид меди и выделяется водород.
