Металлы являются важной группой элементов, которые имеют высокую теплопроводность, электропроводность и обладают способностью формировать положительные ионы. В периодической системе элементов они представлены в нескольких главных подгруппах, каждая из которых имеет свои особенности.
Первая главная подгруппа представлена щелочными металлами - литием (Li), натрием (Na), калием (K) и др. Они отличаются высокой реактивностью и химической активностью. Щелочные металлы легко образуют ионы с положительным зарядом и обычно реагируют с водой, образуя щелочные растворы.
Вторая главная подгруппа представлена щелочно-земельными металлами - магнием (Mg), кальцием (Ca), барием (Ba) и др. Они также образуют положительные ионы, но их реактивность не такая высокая, как у щелочных металлов. Щелочно-земельные металлы находят широкое применение в различных областях, включая строительство и производство сплавов.
Третья главная подгруппа представлена элементами пятой и шестой групп периодической системы - алюминием (Al), галлием (Ga), индием (In) и др. Эти металлы обладают различными химическими свойствами и находят применение в сфере электроники, строительства и производства различных материалов.
Благородные металлы: основные свойства и применение

Благородные металлы – это элементы периодической системы, которые обладают высокой устойчивостью и не реагируют с большинством других веществ. Они отличаются особыми физическими и химическими свойствами, что делает их ценными и востребованными в разных областях науки и техники.
Одной из ключевых особенностей благородных металлов является их невысокая реактивность. Материалы, содержащие благородные металлы, обладают высокой коррозионной стойкостью, что делает их незаменимыми в производстве химических реакторов, элементов аппаратуры ядерной и аэрокосмической промышленности.
Параметры плавления и кипения благородных металлов обычно высокие, что связано с их металлической структурой и способностью образовывать кристаллическую решетку. Благодаря этим свойствам, благородные металлы широко используются в процессах плавления, спекания и сплавления для создания высокопрочных и долговечных материалов. Также их используют в электронике и электротехнике благодаря их отличным электрическим свойствам.
Основные благородные металлы: золото (Au), платина (Pt), серебро (Ag) и палладий (Pd). Золото широко используется в ювелирном производстве и производстве электронных компонентов. Платину применяют в химической промышленности, автопроизводстве и производстве ювелирных изделий. Серебро находит применение в электротехнике, фотографии и медицине. А палладий используется в катализаторах, электронике и производстве стекловолоконных материалов.
Легкие металлы: особенности и применение в промышленности

Легкие металлы - это категория металлов с низкой плотностью, хорошей пластичностью и теплопроводностью. В данную группу входят такие элементы, как алюминий, магний и титан.
Алюминий является одним из наиболее распространенных легких металлов. Он обладает высокой коррозионной стойкостью, что делает его идеальным материалом для производства различных изделий, от авиационных конструкций до упаковочных материалов. Алюминий также широко используется в строительстве благодаря своей легкости и прочности.
Магний - еще один важный легкий металл. Он обладает высокой прочностью, низкой плотностью и отличной устойчивостью к коррозии. Магний применяется в производстве авиационных и автомобильных деталей, а также в производстве спортивных товаров, таких как велосипеды и гольф-клюшки.
Титан является одним из самых легких и прочных металлов в мире. Он отличается высокой устойчивостью к коррозии и огню, что делает его идеальным материалом для производства авиационных и космических конструкций. Титан также используется в медицине, особенно для создания имплантатов и протезов.
В целом, легкие металлы имеют широкий спектр применения в промышленности благодаря своей легкости, прочности и коррозионной стойкости. Они используются в авиации, автомобильной промышленности, строительстве, медицине и других отраслях, где важно сочетание высоких технических характеристик и низкой массы изделий.
Переходные металлы: основные характеристики и применение
Переходные металлы – это элементы таблицы периодов со 3-й по 12-ю главную подгруппы. Они характеризуются наличием переменного заряда, благодаря которому образуют соединения с различными степенями окисления. Внутреннее электронное строение переходных металлов предоставляет им способность формировать стабильные комплексы с различными лигандами. Кроме того, в процессе химических реакций они обладают высокой каталитической активностью.
Особенностью переходных металлов является их способность образовывать полинуклеарные комплексы, в которых обменные взаимодействия между атомами металла обеспечивают особенности их магнитных свойств. Благодаря этому свойству переходные металлы активно применяются в различных областях науки и техники.
Применение переходных металлов находится в широком спектре от металлургии до медицины. Они широко используются в качестве катализаторов в химической промышленности, в частности в процессах гидрогенирования, окисления и пропилении органических соединений. Они также применяются в производстве сплавов, керамики, магнитов и катализаторов автомобильных снижающих выбросы систем.
Переходные металлы активно используются в электронной промышленности, в том числе в производстве полупроводниковых и в технологии изготовления интегральных схем. Они находят применение и в сфере медицины, например, в качестве компонентов противоопухолевых препаратов.
Полуметаллы: свойства и применение в электронике
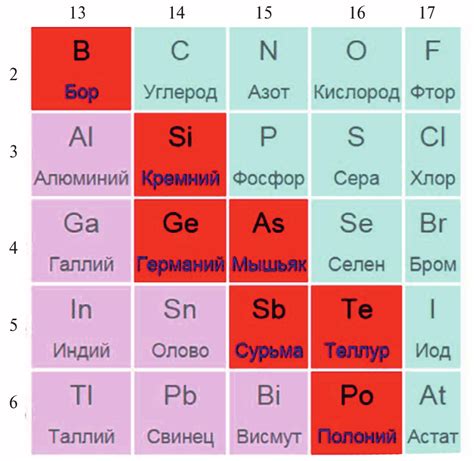
Полуметаллы - это класс химических элементов, которые обладают свойствами как металлов, так и неметаллов. Они являются переходной группой между двумя категориями, поскольку их поведение может быть как металлическим, так и неметаллическим, в зависимости от условий окружающей среды.
Основные свойства полуметаллов - полупроводимость, термоэлектрический эффект и пьезоэлектричество. Эти свойства делают полуметаллы незаменимыми материалами в области электроники и полупроводниковой промышленности. Благодаря способности проводить электрический ток, полуметаллы используются для создания различных компонентов электронных устройств, таких как транзисторы, диоды и твердотельные схемы.
Полуметаллы также находят применение в создании электронных приборов, таких как солнечные батареи и термоэлектрические генераторы. Благодаря своей способности конвертировать тепло и свет в электрическую энергию, полуметаллы играют важную роль в развитии альтернативных источников энергии.
Кроме того, полуметаллы широко используются в производстве полупроводниковых материалов. Они обладают определенными электронными свойствами, которые позволяют использовать их в приборах для контроля и управления электрическим током. Также полуметаллы могут быть использованы в качестве катализаторов в химической промышленности для ускорения химических реакций.
Выводя наши рассуждения, можно заключить, что полуметаллы играют важную роль в современной электронике. Их уникальные свойства делают их идеальными материалами для создания разнообразных электронных устройств и приборов. Благодаря возможности проводить электрический ток и конвертировать энергию, полуметаллы способствуют развитию энергетической и информационной технологий, а также находят применение в химической промышленности.
Щелочные металлы: уникальные свойства и применение в медицине

Щелочные металлы представляют собой группу элементов периодической системы, включающую литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом уникальных свойств, которые делают их важными в различных областях науки и технологий, включая медицину.
Одним из ключевых свойств щелочных металлов является их низкая плотность. Например, литий – самый легкий из всех металлов. Это позволяет использовать их в производстве легких материалов, например, для создания конструкций сниженного веса, что особенно важно в авиационной и космической промышленности.
Еще одной важной особенностью щелочных металлов является их реакционная способность с водой. Они реагируют с водой, образуя щелочные растворы, при этом выделяется водород. Это свойство успешно применяется в медицине при создании аппаратов для выработки и постоянной подачи водорода, который может быть использован в качестве антисептика и антиоксиданта.
Щелочные металлы также имеют способность образовывать соединения с различными элементами. Имея высокую реактивность, они активно вступают в химические реакции, что может использоваться в медицине для синтеза и создания новых лекарственных препаратов. Некоторые их соединения могут обладать антибактериальными, противовоспалительными и противоопухолевыми свойствами, что делает щелочные металлы перспективными компонентами для разработки новых лекарств.
Щелочноземельные металлы: особенности и использование в строительстве

Щелочноземельные металлы - это группа элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они получили свое название благодаря своей позиции в периодической таблице, непосредственно под щелочными металлами. Щелочноземельные металлы обладают рядом особенностей, определяющих их использование в строительстве.
Одной из главных особенностей щелочноземельных металлов является их легковоспламеняемость. Это значит, что они могут воспламеняться при контакте с воздухом или водой, а также быть взрывоопасными в определенных условиях. Из-за этого щелочноземельные металлы широко применяются в производстве взрывоопасных материалов, включая взрывчатые вещества и пиротехнику.
Еще одной важной особенностью щелочноземельных металлов является их высокая термическая и электрическая проводимость. Благодаря этим свойствам, они находят применение в строительстве, особенно при создании электронных компонентов и проводов. Например, магний используется для производства легких сплавов, которые используются в авиационной и автомобильной промышленности, а кальций применяется для создания специальных легированных сталей.
Щелочноземельные металлы также широко используются в строительстве благодаря своей способности образовывать стабильные соединения с кислородом и другими элементами. Например, бериллий используется при создании прочных конструкций для ядерных реакторов, а стронций используется в бетоне для защиты от радиации.
Таким образом, щелочноземельные металлы представляют собой важную группу элементов, которые нашли широкое применение в строительстве. Их уникальные физические и химические свойства делают их незаменимыми в производстве различных материалов и конструкций, которые не только обеспечивают безопасность, но и повышают эффективность и долговечность различных объектов.
Вопрос-ответ

Какие элементы относятся к главной подгруппе металлов?
К главной подгруппе металлов относятся такие элементы как медь (Cu), серебро (Ag), золото (Au), ртуть (Hg) и свинец (Pb).
В чем отличие главных подгрупп от побочных подгрупп металлов?
Главные подгруппы металлов включают элементы, которые находятся в главным образом в первом, втором и третьем периодах таблицы Менделеева, а побочные подгруппы - в последующих периодах. Отличие заключается также в их химической активности и физических свойствах.
Какие металлы являются наиболее распространенными?
Наиболее распространены металлы, принадлежащие к главным подгруппам, такие как железо (Fe), алюминий (Al), никель (Ni), медь (Cu) и свинец (Pb). Эти металлы широко применяются в различных отраслях промышленности и являются основными строительными блоками нашей современной цивилизации.
Чем главные подгруппы металлов отличаются от других групп?
Главные подгруппы металлов отличаются от других групп тем, что в них находятся элементы с более низкой степенью химической активности. Это связано с их электронной структурой и внешней оболочкой электронов. Кроме того, главные подгруппы металлов имеют определенные общие физические свойства, такие как высокая теплопроводность, электропроводность и металлический блеск.
