Электроотрицательность металлов - это химическая величина, которая описывает способность атома металла притягивать к себе электроны в химической связи. Она является одним из важных параметров, определяющих химические свойства металлов и их способность образовывать соединения. Таблица электроотрицательности металлов представляет собой упорядоченный список металлов по возрастанию их электроотрицательности.
У металлов электроотрицательность обычно невысокая, поскольку они имеют большое количество электронов во внешней оболочке и желают избавиться от них, передавая их не металлам. Наиболее электроотрицательными металлами являются литий, калий и натрий, которые находятся в первой группе периодической таблицы.
По таблице электроотрицательности можно судить о том, какие соединения образуются между металлами и неметаллами. Металлы с низкой электроотрицательностью чаще всего образуют ионные соединения с неметаллами, при этом передавая свои электроны. Металлы с высокой электроотрицательностью могут образовывать как ионные, так и координационные связи с неметаллами, при этом образуя с ними сложные соединения.
Металлы и их электроотрицательность
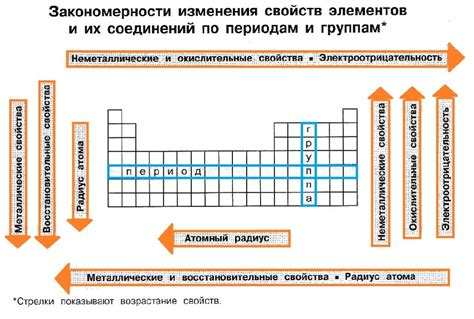
Электроотрицательность - это характеристика атома, определяющая его способность притягивать электроны при образовании химических связей. В химии электроотрицательность является важным параметром при рассмотрении взаимодействия различных элементов и образования химических соединений.
Металлы - группа элементов, обладающих определенными физическими и химическими свойствами. Их особенностью является низкая электроотрицательность в сравнении с неметаллами, что делает их способными отдавать электроны и образовывать положительные ионы, так называемые катионы. Благодаря этому металлы обладают высокой термической и электрической проводимостью, а также могут быть легко деформированы и обладать блеском.
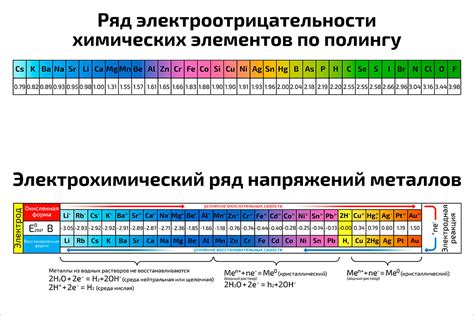
Таблица электроотрицательности металлов позволяет установить и сравнить степень их способности отдавать электроны. Она может быть представлена в виде упорядоченного списка или в виде таблицы. Таблица электроотрицательности металлов включает в себя различные элементы, такие как железо, алюминий, медь, цинк и др.
На основе электроотрицательности металлов можно сделать выводы о возможности образования соединений с неметаллами. Если разность электроотрицательностей двух элементов большая, то возможно образование ионов и образование химических соединений. Например, металл с низкой электроотрицательностью может образовывать катионы, а неметалл с высокой электроотрицательностью может образовывать анионы. Такие соединения называются ионными соединениями.
Таблица электроотрицательности металлов позволяет лучше понять и классифицировать химические свойства элементов. Она широко используется при проведении химических экспериментов и в изучении химических реакций на микро- и макроуровне. Различие в электроотрицательности между металлами является одним из фундаментальных факторов, определяющих поведение элементов в химических процессах.
Значение электроотрицательности в химии

Электроотрицательность в химии является важным понятием, которое отражает способность атома притягивать к себе электроны в химической связи. Этот параметр был впервые введен в 1932 году ученым Линусом Полингом и с тех пор является важным инструментом для объяснения химических свойств веществ.
Значение электроотрицательности определенного элемента в таблице Менделеева позволяет оценить его способность образовывать связи с другими элементами. Чем выше значение электроотрицательности, тем сильнее атом притягивает электроны, что делает его более электроотрицательным.
Знание электроотрицательности элементов позволяет определить тип химической связи, которую образуют атомы вещества. Если разница в электроотрицательности между атомами составляет более 1,7 единицы, то связь будет ионной. Если разница составляет менее 1,7 единицы, то связь будет полярной ковалентной. Если разница равна нулю, то связь будет нековалентной.
Значение электроотрицательности также позволяет предсказывать химические свойства веществ. Например, элементы с высоким значением электроотрицательности, такие как кислород и фтор, обладают большой способностью к образованию химических связей и могут легко реагировать с другими элементами. В то время как элементы с низкой электроотрицательностью, такие как натрий и калий, имеют слабую способность к образованию связей и могут быть более реакционноспособными с элементами из группы галогенов.
Таким образом, значение электроотрицательности является важным показателем в химии, которое помогает понять и предсказывать химические свойства элементов и веществ.
Электроотрицательность металлов и их реактивность
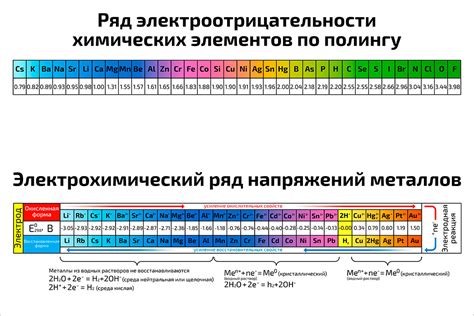
Электроотрицательность – это свойство атомов притягивать к себе электроны в химической связи. Она может служить показателем реактивности металлов. Чем выше электроотрицательность металла, тем больше его способность отдавать электроны и образовывать положительно заряженные ионы.
На основании значений электроотрицательности можно сделать выводы о химической активности металлов. Наиболее реактивными металлами являются щелочные и щелочноземельные металлы, которые характеризуются низкими значениями электроотрицательности.
Наиболее реактивным металлом считается фтор, который обладает наивысшей электроотрицательностью. Фтор способен образовывать сильные кислоты с большинством металлов, окислять их и превращать в соединения с положительно заряженными ионами.
Однако существуют и другие факторы, влияющие на реактивность металлов, такие как размер ионов, структура кристаллической решетки, и т.д. Поэтому электроотрицательность является только одним из показателей активности металлов.
В общем, электроотрицательность металлов играет важную роль в химии, позволяя осуществлять предположения о возможных химических реакциях и взаимодействиях между металлами и другими веществами.
Связь электроотрицательности с химическими свойствами металлов
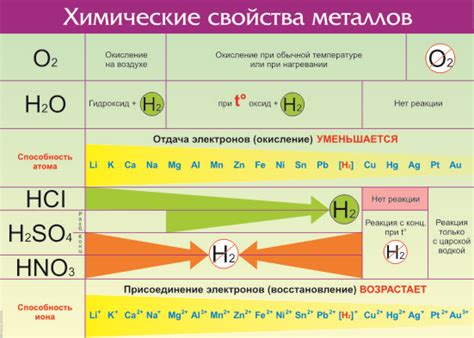
Электроотрицательность является важным химическим понятием, которое определяет способность атома элемента притягивать к себе электроны в химической связи. В контексте металлов электроотрицательность играет важную роль в определении их химических свойств и реакционной способности.
Мetalлы, характеризующиеся низкой электроотрицательностью, обычно обладают следующими свойствами: высокой термической и электрической проводимостью, гибкостью, металлическим блеском и способностью образовывать ионные соединения с элементами, обладающими большей электроотрицательностью. Такое поведение обусловлено тем, что атомы металлов имеют малую электроотрицательность и готовы отдать свои электроны другим элементам, тем самым образуя положительно заряженные ионы, а также обладают свободными электронами в своей зоне проводимости.
С другой стороны, элементы с высоким значением электроотрицательности характеризуются свойствами неметаллов. Они обычно имеют низкую термическую и электрическую проводимость, часто являются хрупкими и образуют ковалентные соединения с другими элементами. Их атомы сильно притягивают электроны, что ведет к образованию отрицательно заряженных ионов или образованию ковалентных связей с соседними атомами.
Таблица электроотрицательности металлов помогает классифицировать элементы на металлы и неметаллы, а также предсказывать их химическую активность и способность вступать в различные реакции. Чем выше электроотрицательность элемента, тем больше вероятность образования ионных или ковалентных соединений с элементами, обладающими более низкой электроотрицательностью.
- Металлы с низкой электроотрицательностью, такие как литий, натрий, калий и другие, образуют ионные соединения с неметаллами, включая хлор, кислород и серу.
- Металлы с более высокой электроотрицательностью, такие как алюминий, медь и цинк, могут образовывать ковалентные соединения с неметаллами или другими металлами с меньшей электроотрицательностью.
В целом, электроотрицательность является важным фактором, влияющим на химические свойства металлов и определяющим их реакционную способность. Зная значения электроотрицательности различных элементов, можно делать выводы о том, какие соединения они могут образовывать и какие реакции они могут выполнять.
Примеры металлов с высокой электроотрицательностью
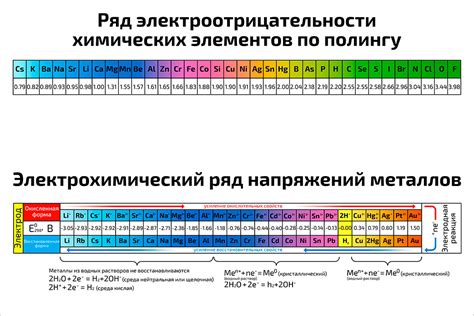
Металлы с высокой электроотрицательностью обладают способностью притягивать электроны в химической связи. Это свойство делает их активными катализаторами и играет важную роль в различных химических реакциях. Некоторые из примеров таких металлов:
- Медь (Cu): Медь имеет высокую электроотрицательность и широко используется в производстве проводников и электроники. Она также применяется в процессах катализа и важна для реакций окисления и восстановления.
- Серебро (Ag): Серебро является одним из самых электроотрицательных металлов и имеет высокую проводимость электричества. Оно используется в ювелирной промышленности, электроде и катализаторе для различных химических реакций.
- Алюминий (Al): Алюминий также обладает высокой электроотрицательностью и широко используется в промышленности и строительстве. Он проявляет хорошую коррозионную стойкость и применяется в производстве авиационных самолетов, автомобильных деталей и упаковки.
Это лишь несколько примеров металлов с высокой электроотрицательностью. Их свойства и применение варьируются в зависимости от специфики каждого металла. Использование этих металлов имеет широкие перспективы в различных областях, включая энергетику, металлургию, катализ и электронику.
Примеры металлов с низкой электроотрицательностью
Электроотрицательность - это химическая характеристика атома, указывающая на его способность притягивать электроны к себе в химической связи. Металлы, характеризующиеся низкой электроотрицательностью, обычно образуют положительные ионы и легко отдают электроны в реакциях.
Одним из примеров металлов с низкой электроотрицательностью является калий (K). Его электроотрицательность составляет всего 0,8 по сколалю. В чистом виде калий представляет собой мягкий, серебристо-белый металл, который легко реагирует с водой, образуя щелочную среду.
Другим примером может быть барий (Ba), чья электроотрицательность составляет 0,9. Барий - металл серебристо-белого цвета, обладающий высокой плотностью и тугоплавкостью. Он хорошо растворяется в кислотах и образует безцветные ионы бария в водных растворах.
Еще одним примером металла с низкой электроотрицательностью является магний (Mg). Его электроотрицательность составляет 1,2. Магний - легкий, серебристо-белый металл, который относится к щелочно-земельным металлам. Он быстро реагирует с водой и кислотами, образуя гидроксид магния и соли.
Все эти металлы имеют низкую электроотрицательность, что делает их хорошими кандидатами для использования в различных промышленных процессах, включая производство металлов, производство стекла, производство удобрений и другие отрасли.
Вопрос-ответ

Какова цель таблицы электроотрицательности металлов?
Целью таблицы электроотрицательности металлов является систематизация информации о электроотрицательности различных металлов с целью дальнейшего использования в химических расчетах и прогнозировании химических свойств веществ.
Как определяется электроотрицательность металлов?
Электроотрицательность металлов определяется на основе их способности притягивать электроны во время химических реакций. Чем больше электроотрицательность металла, тем сильнее он притягивает электроны.
Какие металлы считаются самыми электроотрицательными?
Самыми электроотрицательными металлами являются флуор, кислород, азот и хлор.
Каким образом используется таблица электроотрицательности металлов в химии?
Таблица электроотрицательности металлов используется в химии для определения химической активности и возможных реакций между различными металлическими элементами.
Почему электроотрицательность металлов важна в химии?
Электроотрицательность металлов важна в химии, потому что она позволяет определить вероятность возникновения химических реакций и прогнозировать свойства веществ.
