Металлическая связь является одной из основных форм химической связи и играет важную роль во многих процессах и явлениях, которые наблюдаются в металлах. Она представляет собой особую форму взаимодействия атомов, при которой стабильность полученной структуры обеспечивается общей электронной оболочкой, составленной из свободных электронов. Благодаря этому свободные электроны в металлах способны совершать перемещения и создавать специфический электронный газ.
Одним из распространенных мифов о металлической связи является утверждение о том, что она возникает только в металлах и является их особенностью. Однако это не совсем правда. Металлическая связь может возникать и в неметаллических соединениях, таких как некоторые полупроводники. Ключевым условием для возникновения металлической связи является наличие свободных электронов или свободных уровней энергии, которые могут быть заполнены этими электронами. Это позволяет атомам образовать общую электронную оболочку, что обеспечивает стабильность структуры.
Другой распространенный миф о металлической связи заключается в утверждении, что она является слабой и неустойчивой. Однако это не так. Металлическая связь является достаточно сильной, именно благодаря ей металлы обладают своими характерными физическими и химическими свойствами. Это связано с тем, что электроны в металлах образуют своего рода "море", которые способны свободно двигаться, создавая определенный эффект металлического блеска, хорошей электропроводностью и теплопроводностью.
Металлы внутри молекулы. Как образуется металлическая связь?

Металлическая связь — это тип химической связи, характерный для металлов. Она образуется при взаимодействии свободных электронов, находящихся внутри металлической молекулы.
Металлы обладают особыми свойствами, которые позволяют им образовывать металлическую связь. Одно из таких свойств — наличие большого количества свободных электронов. В металлической структуре, атомы металла расположены в кристаллической решетке, а внешние электроны не принадлежат ни к одному конкретному атому, они являются общим достоянием всех атомов металла внутри молекулы.
Такие свободные электроны играют важную роль в образовании металлической связи. Они образуют «облако» электронов, которое окружает положительно заряженные ядра металлических атомов. Эти электроны организуются в группы, состоящие из двух или более электронов, которые перемещаются вдоль металлической структуры, обеспечивая связь между атомами. Таким образом, металлическая связь обеспечивает высокую электропроводность и теплопроводность металлов.
Металлическая связь также отвечает за другие характерные свойства металлов, например, их тянучесть и пластичность. В металлической связи, атомы металла могут легко смещаться и принимать новую позицию в кристаллической решетке без разрыва связи. Это позволяет металлам сохранять свою структуру при деформации и обладать высокой механической прочностью.
Основные свойства металлов. Почему они обладают высокой электропроводностью?
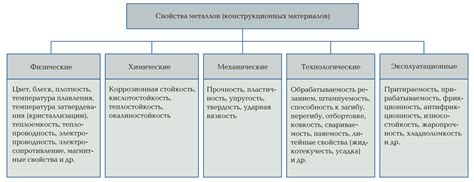
Металлы - это группа веществ, обладающих рядом особых свойств, которые делают их незаменимыми в различных отраслях нашей жизни. Одним из наиболее важных свойств металлов является их высокая электропроводность.
Почему металлы обладают высокой электропроводностью? Это связано с особенностями их структуры и взаимодействия атомов. Металлы состоят из сетки положительно заряженных атомных ядер, вокруг которых находятся свободные электроны. Эти электроны могут свободно перемещаться по сетке металла без значительных препятствий.
Благодаря наличию свободных электронов, металлы могут проводить электрический ток. Когда внешнее электрическое поле приложено к металлу, свободные электроны начинают двигаться в направлении силовых линий поля. Это движение электронов и создает электрический ток.
Высокая электропроводность металлов делает их идеальными материалами для проводников в электрических цепях. Они способны передавать электрическую энергию без значительных потерь. Кроме того, металлы обладают также хорошей теплопроводностью, что делает их эффективными материалами для передачи тепла.
Таким образом, основные свойства металлов, включая высокую электропроводность, объясняются их структурой и наличием свободных электронов. Именно благодаря этим свойствам металлы находят широкое применение в электронике, электротехнике и других отраслях промышленности.
Общепринятые мифы о металлической связи. Что стоит знать?

Металлическая связь является одной из основных составляющих химической связи, возникающей между атомами металлов. Существуют некоторые общепринятые мифы о металлической связи, которые важно разобрать для более полного понимания этого феномена.
- Миф №1: Металлическая связь – это просто сгусток «свободных» электронов. Действительно, свободные электроны играют важную роль в металлической связи, но они не являются единственными участниками этого процесса. Металлическая связь основывается на взаимодействии не только свободных электронов, но и атомов металла, и их энергиях.
- Миф №2: Металлическая связь обязана только наличию свободных электронов. Возможность существования металлической связи зависит не только от наличия свободных электронов, но и от структуры и расположения атомов металла. Кристаллическая решетка металла, образованная атомами, играет важную роль в формировании металлической связи.
- Миф №3: Металлическая связь является самой сильной формой химической связи. Хотя металлическая связь обладает высокой прочностью, она не является самой сильной формой химической связи. Ковалентная связь, например, является сильнее металлической связи, поскольку в ней связанные электроны между двумя атомами.
- Миф №4: Металлическая связь неустойчива и может легко нарушиться. На самом деле, металлическая связь может быть очень стабильной и прочной, особенно в кристаллической решетке металлов. Это объясняет, почему металлы обладают высокой термической и электрической проводимостью, а также имеют высокую температуру плавления и кипения.
Понимание и опровержение этих общепринятых мифов о металлической связи позволяет получить более глубокое представление о механизмах ее образования и свойствах. Металлическая связь играет важную роль во многих аспектах нашей жизни, от производства металлов до создания электронных устройств, и поэтому ее понимание имеет большое значение.
Роль металлической связи в промышленности и науке

Металлическая связь играет важную роль в различных областях промышленности и науки. Ее уникальные свойства позволяют использовать ее для создания различных материалов и устройств.
В промышленности металлическая связь применяется в процессе производства металлических изделий. Благодаря своей прочности и гибкости, металлические связи используются для соединения различных деталей и элементов конструкций. Они обеспечивают надежность и долговечность таких изделий, как автомобили, самолеты, здания и многие другие.
В науке металлическая связь применяется для изучения особенностей металлических соединений и разработки новых материалов. Одной из областей, где металлическая связь находит особое применение, является металлургия. Здесь ее используют для изготовления различных металлических сплавов, исследования их свойств и улучшения технологий их производства.
Металлическая связь также применяется в электронике и электротехнике. Она является основой для создания проводников, контактов и других элементов электрических цепей. Благодаря своей высокой электропроводности, металлическая связь позволяет эффективно передавать электрический ток и обеспечивать надежную работу электронных устройств.
Кроме того, металлическая связь применяется в космической промышленности, медицине, строительстве и многих других областях. В каждом из этих случаев металлическая связь выполняет свою специфическую функцию, обеспечивая надежность, прочность и долговечность различных материалов, изделий и устройств.
Вопрос-ответ

Как образуется металлическая связь?
Металлическая связь образуется в результате взаимодействия свободных электронов с положительно заряженными металлическими ионами. Электроны находятся в общем электронном облаке и свободно перемещаются между ионами, создавая металлическую структуру.
Какие свойства имеет металлическая связь?
Межатомные связи в металлах обладают рядом характерных свойств. Во-первых, металлическая связь обеспечивает хорошую электрическую и теплопроводность металлов. Во-вторых, она отвечает за их пластичность - способность их деформироваться без образования трещин. Также металлическая связь оказывает влияние на оптические свойства металлов и их магнитные характеристики.
Какие факторы влияют на прочность металлической связи?
Прочность металлической связи зависит от ряда факторов, таких как заряд и размеры металлических ионов, количество свободных электронов, их энергия и распределение по энергетическим уровням. Более сильная металлическая связь образуется, если заряд ионов больше и их размеры меньше, а также если количество и энергия свободных электронов больше.
Может ли металлическая связь быть слабой?
Металлическая связь обычно является сильной, что обуславливает характерные свойства металлов, такие как высокая теплопроводность и электропроводность. Однако в некоторых случаях, при особенных условиях, металлическая связь может быть относительно слабой. Например, в некоторых сплавах или при наличии дефектов в кристаллической структуре металла.
Что происходит с металлической связью при нагревании металла?
При нагревании металла возрастает тепловое движение его атомов и ионов, что может вызвать разрыв связей между ними. Однако металлическая связь сохраняется, и металл остается проводником электричества и тепла. При достаточно высоких температурах металлическая связь может стать менее прочной и привести к плавлению и испарению металла.
