Электролиз является важным процессом в химической технологии и используется для различных целей, включая производство металлов и покрытий. Однако, при этом процессе возникает определенный риск растворения металла. Растворение металла может привести к нежелательным последствиям, таким как потеря материала, повреждение оборудования, потеря энергии и загрязнение среды.
Одной из основных причин растворения металла при электролизе является использование несовместимых металлов в аноде и катоде. Когда электрический ток проходит через электролит и создает разность потенциалов между анодом и катодом, металл в анодной зоне может раствориться и перейти в раствор. Это может произойти, например, при использовании железа в качестве анода и меди в качестве катода.
Для предотвращения растворения металла при электролизе необходимо проводить тщательное планирование процесса и правильно подбирать материалы. Один из способов предотвратить растворение металла - использовать совместимые металлы в аноде и катоде. Например, вместо использования железа и меди, можно использовать медь как анод и нержавеющую сталь как катод.
Кроме того, можно использовать защитные покрытия на металлических поверхностях для предотвращения растворения. Такие покрытия могут быть сделаны из пластмассы, керамики или других материалов, которые не растворяются в электролите. Они обеспечивают защиту металла от воздействия электролита и уменьшают вероятность его растворения.
В заключение, растворение металла при электролизе является серьезной проблемой, которую необходимо учитывать при проектировании и проведении электролизных процессов. Правильный выбор материалов и использование защитных покрытий могут помочь предотвратить растворение металла и обеспечить эффективное и безопасное проведение электролиза.
Растворение металла при электролизе:
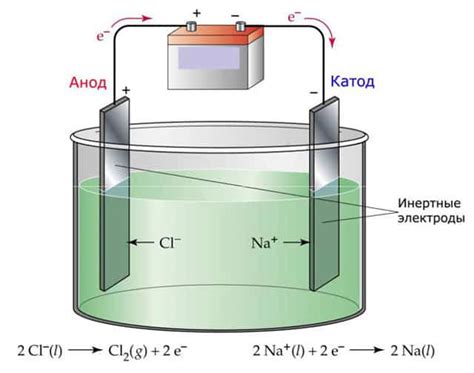
Растворение металла при электролизе – феномен, который может привести к нежелательным последствиям и снижению эффективности процесса. Этот процесс основан на передаче электрического тока через раствор, содержащий металл, и может приводить к разрушению металлической поверхности и уменьшению итогового количества металла.
Одной из причин растворения металла при электролизе является аномальное поведение ионов металла в растворе. Неконтролируемые диффузионные процессы, а также неравномерное распределение электростатических полей, могут приводить к поверхностному растворению металла и образованию микротрещин.
Для предотвращения растворения металла при электролизе применяются различные методы и техники. Одним из них является контроль ионной силы и pH раствора. Увеличение ионной силы может помочь предотвратить растворение металла, а также снизить риск образования микротрещин.
Другим способом предотвращения растворения металла при электролизе является использование защитных покрытий на поверхности металла. Покрытия, такие как пленки оксида или нитрида металла, создают защитный слой, который предотвращает контакт металла с раствором и, следовательно, его растворение.
Также важным фактором является правильный выбор условий электролиза, таких как температура, потенциал и скорость потока ионов. Оптимальные условия электролиза могут способствовать снижению риска растворения металла и повышению эффективности процесса.
В целом, предотвращение растворения металла при электролизе требует комплексного подхода, который включает в себя контроль ионной силы и pH раствора, использование защитных покрытий и оптимизацию условий электролиза. Это позволит сохранить металлическую поверхность и обеспечить успешное проведение электролизного процесса.
Причины и способы предотвращения растворения металла при электролизе

Растворение металла при электролизе может быть вызвано несколькими причинами. Во-первых, неправильно подобранный электролит может привести к растворению металла. Если электролит содержит вещества, которые способствуют растворению металла, то процесс возможного повреждения металла становится неизбежным.
Во-вторых, некачественные электроды могут также стать причиной растворения металла при электролизе. Если электроды содержат примеси или имеют дефекты, то они могут взаимодействовать с металлом и вызывать его растворение. Поэтому важно использовать качественные электроды и контролировать их состояние в процессе электролиза.
Для предотвращения растворения металла при электролизе можно применять несколько способов. Во-первых, правильный выбор электролита является основным условием. Необходимо выбирать электролит, который не содержит веществ, способствующих растворению металла. Также важно контролировать концентрацию электролита, чтобы избежать его переизбытка, который может привести к нежелательному растворению металла.
Во-вторых, следует обратить внимание на качество электродов. Электроды должны быть изготовлены из чистых материалов без примесей, чтобы исключить взаимодействие с металлом в процессе электролиза. Также рекомендуется периодически проверять состояние и целостность электродов и при необходимости их заменять.
- В-третьих, стабилизация процесса электролиза также способствует предотвращению растворения металла. Необходимо контролировать температуру, pH-уровень и ток электролиза, чтобы обеспечить стабильные условия и минимизировать возможные изменения, которые могут привести к растворению металла.
Таким образом, правильный выбор электролита, использование качественных электродов и стабилизация условий электролиза являются ключевыми способами предотвращения растворения металла при электролизе. Это поможет сохранить целостность и качество металлических изделий, проходящих обработку электролизом.
Вопрос-ответ

Почему металл растворяется при электролизе?
Металл растворяется при электролизе из-за процесса окисления и отделения ионов металла от металлической поверхности в результате химических реакций с раствором
Какие могут быть причины растворения металла при электролизе?
Основными причинами растворения металла при электролизе могут быть высокий ток, недостаток защитных преизолирующих пленок, наличие агрессивных компонентов в растворе, неправильный выбор электролита и другие факторы
Какие способы предотвращения растворения металла при электролизе существуют?
К способам предотвращения растворения металла при электролизе относятся: использование защитных пленок на поверхности металла, выбор правильного электролита, контроль тока и напряжения, использование специальных анодов и др.
Какие компоненты раствора могут вызывать растворение металла при электролизе?
Растворение металла при электролизе может быть вызвано компонентами раствора, такими как кислоты, основания, соли, окислители и другие агрессивные вещества, которые взаимодействуют с металлом и вызывают его растворение
Какой электролит можно использовать, чтобы предотвратить растворение металла при электролизе?
Для предотвращения растворения металла при электролизе можно использовать электролиты, которые не растворяют металл или образуют на его поверхности защитные пленки, например, растворы солей, кислот или оснований
