Ковалентная полярная связь – это один из видов химической связи, который возникает между атомами металлов и неметаллов. Основную роль в этом виде связи играют электроотрицательности атомов, что объясняет различные физические и химические свойства веществ.
Металлы обладают свойствами проводить ток, быть гибкими и иметь металлический блеск. Они формируют ковалентные связи с неметаллами, причем эти связи являются полярными. В таких связях электроны металла перераспределяются в направлении неметалла, создавая разность зарядов и полярность связи.
Неметаллы, в отличие от металлов, обладают высокой электроотрицательностью и малой проводимостью тока. В ковалентной полярной связи неметалл притягивает электроны металла к себе и создает разность зарядов. Это объясняет, почему неметаллы обычно образуют молекулы со связями, в которых происходит перераспределение электронов и формирование полярных связей.
Ковалентная полярная связь играет важную роль в химии и определяет множество свойств веществ. Знание о ее особенностях позволяет более глубоко понять химические реакции и взаимодействия между атомами и молекулами.
Металлы и неметаллы: различия в ковалентной полярной связи

Ковалентная полярная связь возникает между атомами металлов и неметаллов и имеет свои особенности в зависимости от химических свойств этих элементов.
Металлы, как правило, обладают малым электроотрицательностью. Это означает, что они имеют слабый электронный заряд и способны легко отдавать электроны. Поэтому в ковалентной полярной связи между металлами и неметаллами электроны переходят от металла к неметаллу, образуя ионную связь. В этом случае металлы проявляют свои металлические свойства, такие как хорошая проводимость тепла и электричества.
Неметаллы, напротив, обладают высокой электроотрицательностью. Они имеют сильный электронный заряд и способны сильно притягивать электроны. В связи с этим, в ковалентной полярной связи между неметаллами и металлами электроны перераспределяются неравномерно, создавая полярную связь. В этом случае неметаллы проявляют свои типичные неметаллические свойства, такие как непроводимость тепла и электричества.
Таким образом, металлы и неметаллы различаются в ковалентной полярной связи: металлы способны отдавать электроны и образовывать ионные связи, а неметаллы сильно притягивают электроны и образуют полярные связи.
Ковалентная связь в металлах

Ковалентная связь - это один из способов образования химической связи между атомами веществ. В отличие от ионной или металлической связи, ковалентная связь характеризуется тем, что электроны образующих ее атомов разделяются между партнерами связи. Ковалентная связь встречается не только в неметаллах, но и в некоторых металлах.
Металлическая связь обычно преобладает в металлах и характеризуется образованием электронного облака, в котором свободные электроны перемещаются между атомами. Однако в некоторых случаях, когда атомы металла образуют ковалентные связи с другими атомами, возникает так называемая ковалентная связь в металле.
Ковалентная связь в металлах может быть вызвана разными факторами. Например, когда атом металла образует связь с радикалом, содержащим неметалл, или с другим атомом металла, у которого есть свободные электроны. Также ковалентная связь может возникать при образовании сплавов, когда атомы различных металлов образуют связи друг с другом.
Ковалентная связь в металлах имеет свои особенности. Например, она может быть полярной, что означает разделение электронов в связи не равномерно. Это связано с тем, что некоторые атомы металла могут иметь большую электроотрицательность, чем другие. Кроме того, ковалентная связь в металлах может быть сильной или слабой в зависимости от характеристик атомов, образующих связь.
Ковалентная связь в неметаллах
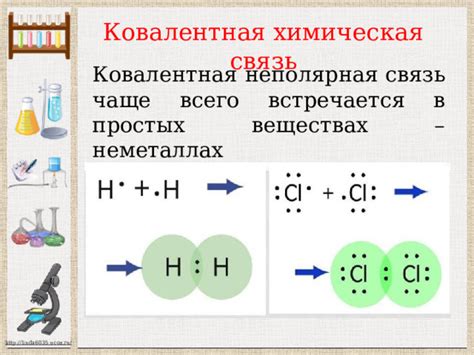
В неметаллах ковалентная связь играет важную роль. Неметаллы, такие как кислород, азот, сера и фтор, обладают высокой электроотрицательностью, что позволяет им образовывать ковалентные связи с другими элементами. Ковалентная связь в неметаллах обусловлена обменом электронами между атомами, которые становятся связанными в результате общего пользования электронами.
Ковалентная связь в неметаллах может быть полярной или неполярной. Полярная ковалентная связь возникает, когда разные элементы разделяют электроны неравномерно – один элемент притягивает электроны сильнее, чем другой. В результате образуется диполь, который создает разность зарядов. Неполярная ковалентная связь возникает, когда электроны между элементами разделяются равномерно, не создавая разности зарядов.
Неметаллы с высокой электроотрицательностью, такие как кислород или фтор, способны образовывать не только одинарные, но и множественные ковалентные связи. Одинарная связь – это обмен одной парой электронов между атомами, двойная связь – обмен двумя парами электронов, а тройная связь – обмен тремя парами электронов.
Важно отметить, что свойства неметаллов, такие как высокая электроотрицательность и способность к образованию ковалентных связей, определяют их химическую активность. Эти элементы имеют склонность к образованию стабильных молекул и соединений с другими элементами, что делает их основными строительными блоками в химических реакциях и составляющими большую часть органических и неорганических веществ.
Влияние электроотрицательности на ковалентную связь
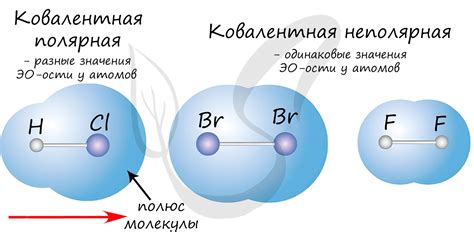
Электроотрицательность химического элемента – это его способность притягивать электроны в химической связи. Влияние электроотрицательности на ковалентную связь наблюдается при образовании молекул и соединений.
Электроотрицательность элементов влияет на силу и полярность ковалентной связи. Если разница электроотрицательностей двух атомов в связи незначительна, то связь будет называться неполярной ковалентной. В этом случае электроны будут проводиться равномерно между атомами связи.
Однако, если разница электроотрицательностей значительна, связь будет полярной ковалентной. В этом случае электроны будут проводиться смещенно в сторону более электроотрицательного атома, образуя дипольную связь. Силу полярной ковалентной связи можно выразить величиной дипольного момента, который зависит от разницы электроотрицательностей и растет с ее увеличением.
Разница в электроотрицательностях также влияет на свойства соединений. Полярные ковалентные связи обладают положительными и отрицательными частями, поэтому молекулы с полярными связями обладают дипольными моментами. Это приводит к таким свойствам, как поларизуемость молекул, смачиваемость, растворимость и т.д.
Таким образом, электроотрицательность элементов играет важную роль в образовании и свойствах ковалентных связей. Это позволяет предсказывать химические свойства веществ на основе их состава и структуры, а также разрабатывать новые материалы с определенными свойствами.
Сравнение прочности ковалентной связи в металлах и неметаллах
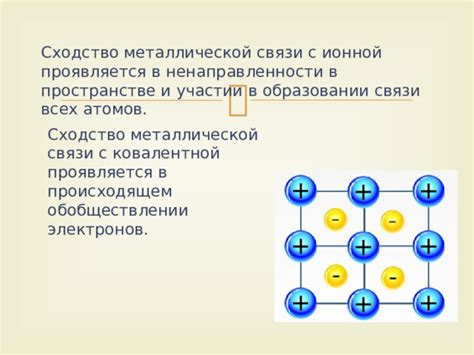
Металлы и неметаллы отличаются не только по химическим свойствам, но и по прочности и стабильности ковалентной связи, которая образуется между атомами в молекулах.
В металлах ковалентная связь обладает высокой прочностью и стабильностью. Это связано с особенностями строения металлической решетки, где атомы образуют кристаллическую решетку и делят свои внешние электроны, образуя общий электронный облако. Это делает металлы твердыми и устойчивыми.
Неметаллы, в отличие от металлов, имеют меньшую прочность ковалентной связи. Это связано с тем, что атомы неметаллов имеют большую электроотрицательность, что приводит к наличию полярности в связи. Из-за этого электроны проводимости не могут свободно перемещаться, что делает неметаллы более хрупкими.
Однако необходимо отметить, что прочность ковалентной связи зависит не только от типа элемента, но и от конкретной молекулярной или кристаллической структуры. Например, некоторые неметаллы, такие как алмаз, обладают высокой прочностью благодаря сложной кристаллической структуре.
В целом, ковалентная связь в металлах обладает более высокой прочностью и устойчивостью по сравнению с неметаллами, однако есть исключения, которые связаны с особенностями структуры и связывания атомов в конкретных веществах.
Примеры веществ, образующих ковалентную полярную связь

Ковалентная полярная связь является типом химической связи, при котором электроны валентной оболочки атомов не равномерно распределены между ними. Это приводит к возникновению полярности в связи и образованию диполя. В результате образуются молекулы со специфическими физическими и химическими свойствами. Вот несколько примеров веществ, образующих ковалентную полярную связь.
- Вода (H2O): В молекуле воды атом кислорода связан с двумя атомами водорода. Кислород имеет большую электроотрицательность, поэтому притягивает электроны сильнее, чем водород. Это приводит к установлению полярной связи между кислородом и водородом. Молекула воды обладает дипольным моментом.
- Аммиак (NH3): В молекуле аммиака атом азота связан с тремя атомами водорода. Азот, также как и кислород в воде, имеет большую электроотрицательность по сравнению с водородом, что приводит к полярной связи. Молекула аммиака также обладает дипольным моментом.
- Сероводород (H2S): В молекуле сероводорода атом серы связан с двумя атомами водорода. Как и в предыдущих примерах, атом серы имеет большую электроотрицательность, атом водорода - меньшую. Это приводит к образованию полярной связи в молекуле сероводорода.
Также есть множество других примеров веществ, образующих ковалентную полярную связь, включая молекулы органических соединений, таких как гидрохлорид этила, фтороформ и др. Ковалентная полярная связь обуславливает множество важных свойств веществ, включая их растворимость, кипение, температуру плавления и т. д.
Вопрос-ответ

Какие элементы обладают ковалентной полярной связью?
Ковалентная полярная связь образуется между атомами, которые отличаются по электроотрицательности. Такими элементами являются, например, кислород, азот, фтор и хлор.
Что представляет собой ковалентная полярная связь?
Ковалентная полярная связь - это связь между атомами, в которой электроны общие для обоих атомов проводят больше времени около одного из них, создавая положительный и отрицательный полюса. Такая связь возникает из-за разности электроотрицательности атомов.
Какие свойства обладают вещества с ковалентной полярной связью?
Вещества с ковалентной полярной связью обычно обладают низкой температурой кипения и плавления, так как эта связь обычно слабее и энергия, необходимая для разрыва связи, невелика. Кроме того, они часто являются хорошими изоляторами электричества.
Как определить, является ли связь ковалентной или ионной?
Связь можно определить, исходя из разности электроотрицательности атомов. Если разность электроотрицательности меньше 1.7, то связь будет ковалентной. Если же разность больше 1.7, то связь будет ионной.
