Металлы являются одной из основных групп элементов в периодической системе. Они характеризуются определенными свойствами, такими как отличная теплопроводность, электропроводность и высокая пластичность. Однако, чтобы понять, почему металлы обладают такими уникальными свойствами, необходимо изучить их внутреннюю структуру.
Атомы металлов состоят из ядра, окруженного электронами. Ядро атома состоит из протонов и нейтронов, а электроны находятся в области вокруг ядра. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны обладают отрицательным зарядом. Сочетание этих зарядов создает электростатическую силу притяжения между частицами атома и обеспечивает его стабильность.
В металлах особенным является способ расположения электронов в оболочках. Оболочки атомов металлов могут содержать до нескольких десятков электронов. У металлов обычно наружная оболочка состоит из небольшого количества электронов, в результате чего атомы металлов имеют очень небольшую электронную оболочку.
Именно эта особенность атомов металлов делает их особыми, когда речь идет о проводимости электричества и тепла.
Очень небольшая электронная оболочка означает, что электроны легко могут двигаться внутри металлической решетки. Это и обеспечивает высокую электропроводность металлов. Электроны могут свободно передаваться от одного атома к другому, создавая электрический ток. Также, из-за близкого расположения электронов, металлы обладают хорошей теплопроводностью, поскольку электроны могут легко передвигаться и передавать тепло.
Обладая отличной электропроводностью и высокой пластичностью, металлы являются неотъемлемой частью многих отраслей промышленности и строительства. Понимание строения атомов металлов позволяет улучшить и оптимизировать свойства их материалов, что является важным шагом в совершенствовании технических решений и разработке новых материалов для различных областей применения.
Строение атомов металлов
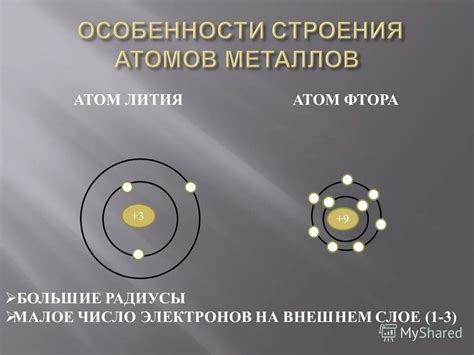
Атомы металлов имеют своеобразное строение, которое определяет их характеристики и свойства. Главной особенностью строения атомов металлов является наличие внешней атомной оболочки, содержащей сравнительно мало электронов. Оболочка состоит из энергетических уровней, на которых расположены электроны.
Внешний энергетический уровень атомов металлов содержит от одного до трех электронов. Такое строение атомов металлов позволяет им легко отдавать или принимать электроны, что объясняет их хорошую проводимость электричества и тепла. Электроны на внешнем уровне называются валентными электронами, и именно они определяют химическую активность металлов.
Строение атомов металлов также характеризуется наличием ядра, которое состоит из протонов и нейтронов. Протоны, заряженные частицы, находятся в центре атома и определяют его атомный номер. Нейтроны не имеют заряда и служат для поддержания стабильности ядра.
Одной из основных особенностей строения атомов металлов является их способность образовывать ионные связи. При образовании ионных связей атомы металлов отдают один или несколько валентных электронов и образуют положительно заряженные ионы. Эти ионы образуют кристаллическую решетку, которая придает металлам их характерные физические свойства, такие как металлический блеск, пластичность и хорошую проводимость электричества и тепла.
Особенности атомов металлов

Атомы металлов обладают некоторыми характеристиками, которые делают их особенными. Одной из особенностей является наличие большого количества электронов во внешней оболочке – валентной области атома. Это позволяет атомам металлов образовывать межатомные связи и формировать кристаллическую решетку, что делает их твердыми и хорошо проводящими тепло и электричество.
Еще одной особенностью атомов металлов является наличие свободных электронов в валентной области, которые могут перемещаться по кристаллической решетке. Это обусловливает высокую электропроводность металлов, так как свободные электроны способны переносить электрический ток.
Также стоит отметить, что атомы металлов имеют больший размер и массу по сравнению с атомами других элементов. Благодаря этому, металлы обладают высокой плотностью и тяжестью. Большой размер атомов металлов также способствует их способности образовывать металлические соединения и сплавы с другими элементами.
И еще одной важной особенностью атомов металлов является их способность образовывать ионные соединения с неметаллами. В результате окисления металлов, атомы металлов теряют электроны и превращаются в положительно заряженные ионы. Благодаря этому, металлы могут образовывать стабильные ионные соединения с отрицательно заряженными неметаллами.
Химические свойства атомов металлов

Атомы металлов обладают рядом химических свойств, которые отличают их от атомов других элементов. В основном, это связано с их строением и способностью образовывать ионы.
Атомы металлов имеют относительно небольшую электроотрицательность, что делает их склонными к потере электронов. Это свойство позволяет металлам образовывать положительно заряженные ионы, называемые катионами.
Катионы металлов обладают высокой степенью химической активности. Они могут легко вступать в реакции с другими веществами и часто образуют соли, оксиды и гидроксиды.
Атомы металлов могут также образовывать комплексные соединения с различными лигандами. Лиганды - это атомы или группы атомов, которые координируются к металлу и образуют стабильную структуру.
Химические свойства атомов металлов также определяют их способность проводить электрический ток. При потере электрона, атом металла становится положительно заряженным и образует электрические связи с соседними атомами. Это позволяет создавать металлическую структуру с высокой проводимостью электрического тока.
Строение валентной оболочки атомов металлов
Строение атомов металлов определяется взаимодействием и расположением электронов в их валентной оболочке. Валентная оболочка - это наиболее внешняя оболочка атома, которая содержит электроны, участвующие в химических реакциях.
Атомы металлов имеют характерные особенности в строении своей валентной оболочки. Одной из них является наличие у металлических атомов свободных или полностью заполненных d- и f-подобных подуровней. В d-подуровнях металлических элементов можно наблюдать две группы элементов: переходные металлы, у которых имеется неполностью заполненный d-подуровень, и благородные металлы, у которых d-подуровень полностью заполнен или почти полностью заполнен.
У атомов металлов с неполностью заполненными d- и f-подуровнями электроны могут свободно перемещаться и образовывать металлические связи. Это позволяет металлам обладать специфическими физическими и химическими свойствами, такими как высокая теплопроводность и электропроводность.
Также валентная оболочка атомов металлов может содержать электроны, находящиеся на s-подуровне. Эти электроны участвуют в образовании ионных связей с другими атомами, что позволяет металлам образовывать химические соединения с различными элементами.
В целом, строение валентной оболочки атомов металлов определяет их химические свойства и возможность образования различных соединений. Изучение этого строения позволяет более глубоко понять физические и химические свойства металлических элементов и использовать их в различных областях науки и техники.
Электронная конфигурация атомов металлов

Металлы - это элементы, которые обладают характерными свойствами, такими как высокая теплопроводность, электропроводность и металлический блеск. Эти свойства связаны с особенностями строения атомов металлов и их электронной конфигурацией.
Атомы металлов имеют основную электронную конфигурацию, которая характеризуется заполнением энергетических уровней и подуровней электронами. Основные энергетические уровни обозначаются числами от 1 до 7, а подуровни обозначаются буквами s, p, d, f. Например, электронная конфигурация атома натрия (Na) - 1s2 2s2 2p6 3s1.
Атомы металлов имеют общую особенность - они стремятся достичь стабильности путем заполнения своего внешнего энергетического слоя. Для большинства металлов внешний слой состоит из s- и p-подуровней, и в результате металлы стремятся заполнить эти подуровни, чтобы достичь электронной конфигурации инертного газа.
Например, атом натрия (Na) имеет электронную конфигурацию 1s2 2s2 2p6 3s1. Внешний энергетический слой состоит из 3s-подуровня, и атом натрия стремится заполнить этот подуровень, потеряв один электрон. Это делает атом натрия положительно заряженным и образующим ион Na+.
Таким образом, электронная конфигурация атомов металлов определяет их химические и физические свойства, а также их способность образовывать положительно заряженные ионы.
Электронный обмен в металлах

Металлы являются хорошими проводниками электричества и тепла, благодаря особенностям их электронной структуры. В основе электронной проводимости лежит процесс электронного обмена в металлах.
В металлах электроны в валентной области имеют высокую подвижность и свободно перемещаются по кристаллической решетке. Это происходит благодаря отсутствию полностью заполненных энергетических уровней внешней оболочки атома металла.
В процессе электронного обмена, один электрон передает энергию или импульс другому электрону, что приводит к возникновению электронной проводимости. Электроны движутся по металлу, взаимодействуя с положительно заряженными ядрами атомов.
Электронный обмен между электронами основан на принципах квантовой механики и квантовой теории твердого тела. Он описывается моделью "электронного газа", где электроны можно представить как свободные частицы, движущиеся в атомной сетке.
Электронный обмен в металлах играет важную роль не только в процессе проводимости электричества, но и в формировании других свойств металлов, таких как термическая проводимость, пластичность и магнитные свойства. Изучение электронного обмена в металлах позволяет лучше понять их физические свойства и использовать их в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Какое строение атомов металлов и какие особенности оно имеет?
Атомы металлов обладают кристаллической структурой. Они расположены в решетке, где каждый атом окружен другими атомами. Благодаря этому особенному строению, атомы металлов имеют возможность образовывать связи между собой и образовывать металлические свойства.
Какие характеристики имеют атомы металлов?
Атомы металлов имеют низкую электроотрицательность, что означает, что они обладают способностью отдавать электроны. Они также имеют большой размер и высокую подвижность, что объясняет их способность проводить ток и тепло.
