Металлы являются одними из самых прочных и долговечных материалов, однако существуют некоторые вещества, способные быстро разъесть металлические поверхности. Это могут быть кислоты, щелочи, соли и даже газы. Взаимодействие металлов с такими веществами может привести к коррозии, разрушению или даже взрыву.
Кислоты являются одними из наиболее сильных разъедающих веществ. К примеру, серная кислота может разъесть алюминий, железо и медь, образуя при этом соответствующие соли. Нитратная кислота способна растворить многие металлы, включая цинк и железо, а хлороводородная кислота может разъесть Железо-никель и никель-хромовые сплавы.
Щелочи, такие как натриевая гидроксид и калиевая гидроксид, также проявляют сильные разъедающие свойства. Они образуют щелочные растворы, которые могут разъесть алюминий, цинк, медь и другие металлы. Некоторые из них, например, натриевый гидроксид, даже используются в бытовых моющих средствах и отчасти способны разъесть ржавчину.
Соли с определенными химическими свойствами также могут растворять металлы. Например, сульфаты, хлориды, нитраты и фосфаты различных металлов могут образовывать растворы, которые способны разъесть металлическую поверхность. Некоторые из таких солей могут быть использованы в процессе гальванизации или электрохимического оксидирования.
Газы также могут оказывать разъедающее действие на металлы. Например, газы сернистого газа, аммиака и хлора могут вызывать коррозию металлических поверхностей. Они реагируют с металлами и образуют соответствующие соли или окислы, что приводит к их разрушению.
Важно отметить, что разъедающие свойства веществ могут существенно различаться в зависимости от многих факторов, таких как концентрация вещества, температура, время контакта и состояние металлической поверхности. Поэтому, при работе с разъедающими веществами необходимо соблюдать все необходимые меры безопасности и осторожности.
Кислотные вещества, разъедающие металл

Кислотные вещества являются одними из наиболее эффективных разъедающих агентов металла. Они обладают способностью проникать в поверхностный слой металла и изменять его структуру и свойства. При контакте с металлом кислоты происходит химическая реакция, которая приводит к образованию коррозионных продуктов.
Среди кислотных веществ, способных разъедать металлы, особенно выделяются такие химические соединения, как соляная кислота (HCl), азотная кислота (HNO3) и серная кислота (H2SO4). Эти кислоты обладают сильной коррозионной активностью и широко применяются в промышленности, научных исследованиях и медицине.
Соляная кислота является одной из наиболее агрессивных кислот. Она способна разъедать множество металлов, включая железо, алюминий, цинк и медь. Взаимодействие соляной кислоты с металлом приводит к выделению водорода и образованию соли металла. Азотная кислота обладает подобными свойствами и также способна разъедать металлы с образованием соответствующих солей.
Серная кислота является наиболее распространенной кислотой в промышленных процессах. Она способна разъедать различные металлы, включая железо, алюминий, цинк, свинец и медь. Взаимодействие металла с серной кислотой приводит к образованию солей, таких как сульфаты, и выделению сернистого газа.
Важно отметить, что использование кислотных веществ для разъедания металлов требует особой осторожности и соблюдения мер безопасности. Кислоты являются ядовитыми и коррозионно-опасными веществами, поэтому при работе с ними необходимо использовать защитное снаряжение, проводить работу в хорошо проветриваемом помещении и следить за условиями хранения и использования.
Агрессивные растворы серной кислоты

Серная кислота является одним из самых агрессивных и опасных химических веществ. Ее растворы обладают высокой реактивностью и способны быстро разъесть металлы.
Взаимодействие серной кислоты с металлом протекает по ряду химических реакций. Вначале происходит образование сернистого ангидрида, который далее реагирует с водой и образует серную кислоту. Данный процесс сопровождается выделением тепла и выбросом вредных газов, таких как сернистый ангидрид и диоксид серы.
Агрессивность растворов серной кислоты обусловлена их способностью сильно окислять металлы. При контакте раствора с металлом происходит окислительно-восстановительная реакция, в результате которой металл окисляется и серная кислота восстанавливается. Такая реакция является энергетически выгодной и протекает с выделением энергии в виде тепла.
Серная кислота может разъесть практически все металлы, включая железо, алюминий, цинк, свинец и другие. Некоторые металлы, такие как платина и золото, более устойчивы к воздействию серной кислоты и могут сохранять свою структуру даже при длительном контакте с ее раствором.
Важно отметить, что работа с серной кислотой требует особых мер предосторожности и соблюдения правил безопасности. При работе с этим агрессивным веществом необходимо использовать защитную экипировку, такую как резиновые перчатки, защитные очки и специальную одежду. Delegate воздействие кислоты на кожу и слизистые мембраны может вызвать химические ожоги и серьезные повреждения.
Хлорные соединения, разрушающие металлы

Хлорные соединения способны эффективно и быстро разъесть металлы, вызывая их коррозию и разрушение. Это связано с химическими свойствами хлора и его соединений.
Хлор является очень активным элементом, который образует сильные химические связи с металлами. Хлорные соединения имеют высокую реакционную способность и могут проникать в металлическую структуру, взаимодействуя с ней и вызывая ее разрушение.
Одним из наиболее известных хлорных соединений, разрушающих металлы, является хлорид железа (III). Это сильный окислитель, который образует стабильные соединения с различными металлами, такими как железо, алюминий и цинк. Хлорид железа вызывает коррозию металлической поверхности и приводит к ее постепенному разрушению.
Также хлорные соединения, такие как хлорид меди и хлорид цинка, могут разрушить металлы. Они обладают агрессивными химическими свойствами и вызывают быструю коррозию металлической поверхности. Хлорид меди образует бляшки и пятна на медных изделиях, а хлорид цинка вызывает коррозию цинковых покрытий на стальных изделиях.
Однако не все металлы одинаково подвержены разрушению хлорными соединениями. Например, нержавеющая сталь обладает повышенной устойчивостью к коррозии и может быть использована в условиях, где присутствуют хлорные соединения. Также некоторые металлы, например, алюминий, образуют защитную оксидную пленку, которая предотвращает их разрушение хлорными соединениями.
Соли фтороводорода и иные фтористые вещества
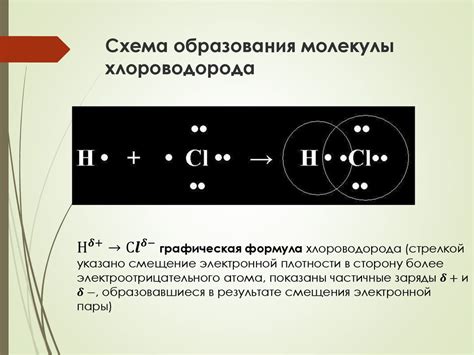
Соли фтороводорода и другие фтористые вещества являются крайне коррозионно-активными веществами, способными быстро разъесть металлы. Фтористые соединения обладают сильными окислительными свойствами и реагируют с многими металлами, вызывая их разложение и образование растворов.
Соли фтороводорода, такие как гидрофторид натрия и гидрофторид калия, содержат в своей структуре ионы фтора, которые проявляют высокую активность в отношении металлов. При контакте с металлами их молекулы диссоциируют, высвобождая фторидные и гидроксидные ионы, которые образуют агрессивное окружение для металлической поверхности.
Взаимодействие солей фтороводорода с металлами приводит к образованию соответствующих фторидов, при этом происходит их активное изменение: металл окисляется, а фтористые соединения претерпевают диссоциацию.
Некоторые другие фтористые вещества, например галогениды металлов, обладают аналогичными свойствами и также способны вызывать быструю коррозию металлов. Эти вещества химически активны, реагируют с металлами даже при комнатной температуре и способны проникать вглубь металлической структуры, вызывая ее разрушение.
Тиль (кислота плавиковая) и ее воздействие на металлы

Тиль (также известная как кислота плавиковая) представляет собой химическое вещество с кислотными свойствами, которое обладает способностью разъедать металлы.
Ее воздействие на металлы происходит в результате процесса, называемого коррозией. Тиль обладает высокой коррозионной активностью, особенно когда растворена в воде или других растворителях. Воздействие этой кислоты на металлы приводит к разрушению их структуры и образованию коррозионных процессов.
Особенно чувствительны к воздействию тиля активные металлы, такие как алюминий, магний и цинк. Они реагируют с кислотой, образуя соли и выделяяся газы. Результатом воздействия тиля на эти металлы может быть их растворение или даже полное разрушение.
Тиль также может влиять на другие металлы, такие как железо и сталь, однако его воздействие на них может быть менее интенсивным. Металлы, покрытые оксидными слоями, могут быть более устойчивыми к действию тиля.
В заключение, тиль (кислота плавиковая) является химическим веществом, способным быстро разъесть металлы. Особенно подвержены коррозии активные металлы, такие как алюминий, магний и цинк. При работе с тилью необходимо принимать меры предосторожности и соблюдать все необходимые меры безопасности.
Аммиачная селитра и металлические поверхности

Аммиачная селитра (NH4NO3) — это химическое вещество, которое может оказывать разъедающее действие на некоторые металлические поверхности. Это вещество является составной частью многих удобрений и часто используется в сельском хозяйстве.
При контакте аммиачной селитры с металлами, такими как алюминий, цинк или медь, может происходить химическая реакция, которая приводит к разрушению металлической поверхности. Аммиак и нитратные ионы, содержащиеся в аммиачной селитре, могут реагировать с металлами, вызывая их окисление и коррозию.
Однако, не все металлы подвержены воздействию аммиачной селитры. Например, сталь и нержавеющая сталь защищены от разъедающего действия этого вещества благодаря защитной оксидной пленке, которая образуется на их поверхности.
В целом, взаимодействие аммиачной селитры с металлами может зависеть от конкретных условий и обстоятельств, таких как концентрация и температура раствора, время контакта и т.д. Поэтому, перед применением аммиачной селитры на металлических поверхностях, необходимо учитывать ее потенциальные разъедающие свойства и принимать соответствующие меры предосторожности.
Действие гидроксида натрия на металлические объекты

Гидроксид натрия, также известный как щелочная сода или еда, является химическим соединением, которое может проявлять крайне агрессивные свойства в отношении некоторых металлов.
Металлы, такие как алюминий, цинк и свинец, способны реагировать с гидроксидом натрия и переходить в ионы, образуя при этом гидроксид металла и соль натрия. Данная реакция является экзотермической, что означает выделение тепла.
Пример реакции гидроксида натрия на алюминий:
- 2NaOH(aq) + 2Al(s) → 2NaAlO2(aq) + H2(g)
Результатом данной реакции является образование гидроксида алюминия (NaAlO2) и освобождение водорода. Гидроксид натрия при этом играет роль окислителя, алюминий – восстановителя.
Важно отметить, что реакция гидроксида натрия с металлами может приводить к разрушительным последствиям, так как гидроксид натрия является сильным щелочным раствором. При неосторожном обращении с ним может происходить коррозия металлических поверхностей.
Поэтому при работе с гидроксидом натрия необходимо соблюдать предосторожность, надевать защитные средства и следить за тем, чтобы реакция не происходила в закрытых или ограниченных пространствах.
Вопрос-ответ

Какие вещества могут разъесть металл?
Наиболее известными веществами, способными быстро разъесть металл, являются кислоты, особенно сильные и концентрированные, такие как серная и соляная кислоты. Они могут вызывать химическую реакцию, при которой металл может раствориться или образовать окисную пленку.
Какие кислоты разъедают металлы?
Серная кислота и соляная кислота являются самыми распространенными кислотами, способными разъесть металлы. Они оба могут вызывать эрозию металла и растворение его поверхности, однако кислотная атака может быть быстрой или медленной в зависимости от концентрации кислоты и свойств металла.
Каким образом кислоты разъедают металлы?
Когда металл попадает в контакт с кислотой, происходят химические реакции, в результате которых идет процесс окисления металла. Кислота высвобождает ионы водорода, а металл делится на ионы металла, которые постепенно растворяются в кислоте. Это может привести к разрушению и растворению металла.
Какие другие вещества могут разъесть металл?
Помимо кислот, некоторые другие вещества могут также разъесть металлы. Например, некоторые соли, такие как хлорид натрия и хлорид меди, могут вызывать коррозию металлов. Также аммиак и некоторые органические растворители могут быть агрессивны к металлам.
Возможно ли предотвратить разъедание металла?
Да, существуют различные методы для предотвращения разъедания металла. Один из самых распространенных способов - покрытие металла защитным покрытием, таким как оксиды, лаки или пластиковые покрытия, которые предотвращают контакт металла с разъедающими веществами. Также можно использовать специальные составы, которые образуют защитную пленку на поверхности металла и предотвращают коррозию.
