Химическая связь металлов является фундаментальным понятием в химии. Она описывает, как атомы металлов взаимодействуют друг с другом и образуют специфические структуры и соединения. Правильная запись химической связи металлов позволяет установить структуру и свойства соединения, а также предсказать его поведение в реакциях и каталитических процессах.
При записи химической связи металлов следует учитывать несколько основных принципов. Во-первых, необходимо указать тип связи, которая может быть ионной, ковалентной или металлической. Кроме того, нужно обозначить атомы металлов, участвующие в связи, и их заряды. Также важно указать количество и тип дополнительных атомов или групп, являющихся частью связи.
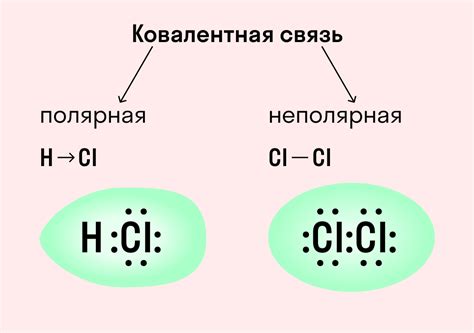
Для правильной записи химической связи металлов можно использовать специальные обозначения и символы. Например, для обозначения ионной связи можно использовать знаки плюс и минус, чтобы указать заряды атомов. Для ковалентной связи можно использовать стрелку, указывающую направление перемещения электронов. При записи металлической связи удобно использовать точки, чтобы показать, что электроны сами по себе являются движущимися частицами.
Что такое химическая связь?
Химическая связь – это устойчивая сила, которая держит атомы в молекулах и ионы в кристаллах вещества вместе. Она возникает из-за взаимодействия электронов во внешних энергетических оболочках атомов.
Химическая связь играет важную роль в химии и определяет физические и химические свойства веществ. Она позволяет атомам и ионам объединяться и образовывать соединения, что приводит к появлению новых химических веществ.
В химии выделяют несколько видов химической связи, таких как ионная связь, ковалентная связь, металлическая связь и водородная связь. Каждый из этих видов связей обладает своими особенностями и характеристиками.
Изучение химической связи позволяет более глубоко понять природу химических реакций и предсказывать их результаты. Это является фундаментом для разработки новых химических соединений и материалов, что имеет важное значение для различных отраслей промышленности и научных исследований.
Особенности химической связи в металлах

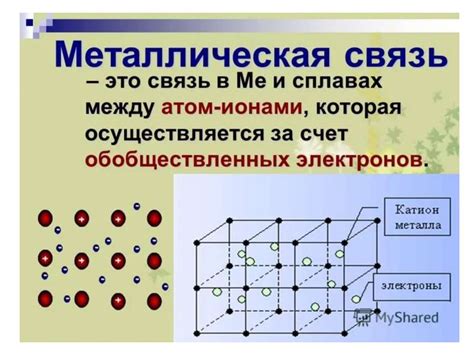
Химическая связь в металлах имеет свои особенности, отличающие ее от связи между атомами в молекулах. Суть химической связи в металлах заключается в образовании так называемой "электронной облакности", где свободные электроны металла перемещаются между атомами.
Главной особенностью химической связи в металлах является электронная дефективность атомов металла. Атомы металла обладают малым числом электронов в валентной оболочке, что обусловлено большим размером ядра и слабым удержанием электронов. Это приводит к возникновению свободных электронов, которые образуют электронное облако вокруг атомов металла.
Электроны, находящиеся в электронной облакности, обеспечивают металлам их характерные свойства, такие как электропроводность, теплопроводность, пластичность и металлический блеск. Свободные электроны металла могут свободно перемещаться по облаку и образовывать так называемую "море электронов".
Химическая связь в металлах многообразна и может быть представлена в различных структурах, таких как кристаллическая решетка и аморфная структура (без определенного порядка). Кристаллическая решетка в металлах образуется за счет упорядоченного расположения атомов в трехмерной структуре.
В итоге, особенности химической связи в металлах связаны с формированием электронной облакности и ее свободным движением, что придает металлам их характерные свойства и позволяет им образовывать различные структуры.
Способы записи химической связи металлов
Химическая связь металлов описывается различными способами с использованием определенных обозначений и символов. Одним из самых распространенных способов записи является электронная формула, которая позволяет указать количество электронов, участвующих в образовании связи.
В электронной формуле металла указываются его символ и количество валентных электронов, расположенных во внешней энергетической оболочке. Например, для железа электронная формула будет выглядеть как Fe(2,8,14,2), где число 2 указывает на количество валентных электронов.
Другим способом записи химической связи металлов является использование стрелок и плюсов. При этом направление стрелки указывает на передачу электронов от металла к неметаллу. Например, в случае образования ионной связи между натрием и хлором запись будет выглядеть как Na → Cl +.
Также можно использовать символы катиона и аниона для обозначения химической связи между металлами. Например, для образования ионной связи между калием и кислородом запись будет выглядеть как K+ + O2-.
Некоторые химические связи металлов могут быть представлены в виде таблицы, где указываются элементы металлов и химические формулы связи между ними. Например:
| Металл 1 | Металл 2 | Химическая формула |
|---|---|---|
| Натрий | Хлор | Na + Cl |
| Калий | Кислород | K+ + O2- |
Все эти способы записи химической связи металлов позволяют более наглядно и точно описать процессы образования и разрушения связей между металлами и другими веществами.
Примеры записи химической связи металлов
Химическая связь металлов может быть записана различными способами в химических формулах. Одним из наиболее распространенных способов записи связи металлов является использование ионного заряда металла и его атомного номера.
Например, связь между натрием и хлором может быть записана как Na+Cl-, где знак "+" указывает на положительный ион металла, а знак "-" - на отрицательный ион неметалла.
Еще одним способом записи химической связи металлов является использование атомных символов металла и неметалла, соединенных через дефис. Например, связь между медью и серой может быть записана как Cu-S.
Также возможно использование ионного символа металла в квадратных скобках и атомного символа неметалла. Например, связь между железом и кислородом может быть записана как [Fe]O.
Кроме того, в записи химической связи металлов может использоваться численное отношение атомов металла и неметалла. Например, связь между кальцием и азотом может быть записана как Ca3N2.
Таким образом, химическая связь металлов может быть записана различными способами в химических формулах, в зависимости от выбранного подхода к представлению связи.
Роль химической связи металлов в различных процессах

Химическая связь металлов играет важную роль во многих процессах и явлениях, связанных с металлургией, электрохимией и физико-химическими свойствами металлов.
Одной из главных функций химической связи металлов является предоставление им характерных физических и химических свойств. Металлы обладают способностью образовывать сильные металлические связи, в результате которых образуются металлические кристаллические решетки. Это обеспечивает металлам высокую пластичность, термическую и электропроводность, а также способность к формированию специфических физических состояний, таких как магнетизм или суперпроводимость.
В процессе экстракции металлов из руды химическая связь металлов играет ключевую роль. Она определяет степень слабости или силы связи между металлом и другими элементами руды. В зависимости от этой связи могут быть выбраны специфические методы обработки или извлечения металла из руды, такие как плавка, электролиз или химические реакции.
В электрохимии химическая связь металлов используется для создания электролитических ячеек и гальванических элементов. Металлы с разными электрохимическими свойствами могут вступать в реакции окисления и восстановления, образуя электрическую силу тока. Такие процессы используются в батареях, аккумуляторах и различных электронных устройствах.
Также, химическая связь металлов имеет значение при производстве сплавов и легированных материалов. Соединение металлов различной природы или добавление специфических элементов позволяет изменять и улучшать свойства материала, такие как прочность, твердость, коррозионная стойкость и температурная устойчивость. Это широко применяется в авиационной, автомобильной и строительной промышленности, где требуются материалы с определенными физическими и химическими свойствами.
В заключение, химическая связь металлов играет решающую роль во многих отраслях науки и промышленности. Она определяет физические и химические свойства металлов, позволяет извлекать и обрабатывать металлы, создавать электрохимические устройства и производить сплавы с улучшенными свойствами. Изучение химической связи металлов является важной задачей в химии и материаловедении для развития новых технологий и создания более совершенных материалов.
Вопрос-ответ

Какие способы существуют для записи химической связи металлов?
Существует несколько способов записи химической связи металлов. Один из них - использование обозначений элементов и их зарядов. Например, если металл имеет заряд "+2", а другой элемент имеет заряд "-1", то связь между ними будет обозначаться как "Металл2+ - Элемент1-". Второй способ - использование точек и линий для обозначения электронов. Каждая точка представляет электрон, а линия - обозначает связь между атомами. Например, связь между металлом и элементом будет записываться как "Металл•• - Элемент•".
Какие еще варианты записи химической связи металлов можно использовать?
Помимо уже описанных способов, можно также использовать стрелки для обозначения направления движения электронов в связи. Например, если электроны переносятся от металла к элементу, то можно записать "Металл → Элемент". Если электроны переносятся от элемента к металлу, то запись будет "Металл ← Элемент". Также можно использовать цифры и символы "+" и "-" для обозначения зарядов элементов и их электронных составляющих.
Как правильно записать связь между атомами металлов?
Связь между атомами металлов можно записать, используя сокращенные обозначения элементов и их заряды. Например, для связи между атомами кальция и магния можно использовать запись "Ca+ - Mg2+". Также можно использовать стрелки для обозначения направления движения электронов и указывать заряды элементов в скобках. Например, связь между металлом и элементом вида "Металл (заряд) - Элемент (заряд)" или "Металл (заряд) → Элемент (заряд)".
Как можно записать связь между атомом металла и молекулой газа?
Связь между атомом металла и молекулой газа можно записать, указывая обозначения элементов, их заряды и стрелки для обозначения направления движения электронов. Например, для связи между атомом натрия и молекулой кислорода можно записать "Na+ - O2". Также можно использовать цифры для обозначения количества связей между атомами.
