Щелочные металлы (литий, натрий, калий, рубидий, цезий) являются группой элементов, химически активных в своих реакциях. Галогены (фтор, хлор, бром, йод) также обладают высокой химической активностью и относятся к группе элементов, с которыми щелочные металлы часто образуют соединения.
Реактивные соединения щелочных металлов с галогенами проявляются в формировании солей и галогенидов. Процесс образования соединений между щелочными металлами и галогенами часто сопровождается ярко выраженными химическими реакциями, такими как газовыделение, нагревание, светло-подобные явления и даже взрывы.
Например, смешивая металл натрий (Na) с галогеном хлором (Cl), можно наблюдать вспышку яркого света и образование соли - хлорида натрия (NaCl). Такая реакция является типичным представителем химического взаимодействия между щелочными металлами и галогенами.
При образовании соединений между щелочными металлами и галогенами, галоген обычно забирает электрон у щелочного металла, образуя отрицательно заряженный ион - анин, а щелочный металл, в свою очередь, становится положительно заряженным ионом - катионом. Такое взаимодействие свидетельствует о высокой химической реактивности обоих групп элементов.
Химические свойства реактивных соединений щелочных металлов с галогенами зависят от конкретного сочетания элементов и условий, в которых происходит реакция. Изучение этих свойств позволяет понять особенности химической активности группы щелочных металлов и галогенов, а также применить полученные знания в различных областях науки и техники, включая производство химических соединений и материалов.
Определение щелочных металлов и галогенов
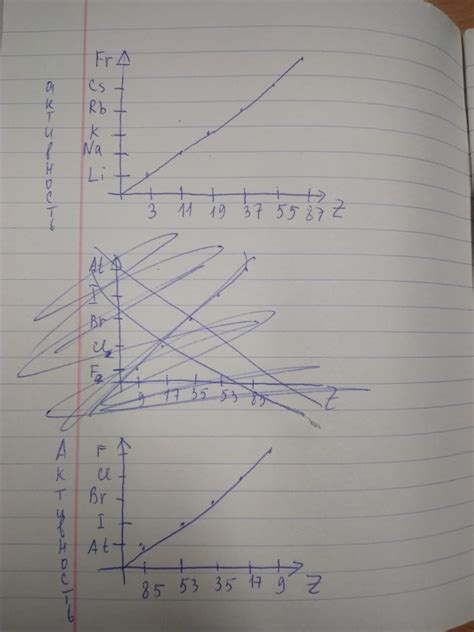
Щелочные металлы – это химические элементы, которые относятся к первой группе периодической системы элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой активностью, легко окисляются и образуют щелочные оксиды и гидроксиды.
Галогены – это химические элементы, которые относятся к седьмой группе периодической системы элементов. К галогенам относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Галогены обладают высокой электроотрицательностью, образуют сильные окислители и часто реагируют с металлами, образуя ионные соединения.
Щелочные металлы и галогены обладают противоположными химическими свойствами. Щелочные металлы проявляют металлические свойства, такие как хорошая электропроводность и тугоплавкость. Галогены, напротив, обладают неметаллическими свойствами, такими как высокая электронегативность и хрупкость.
Взаимодействие щелочных металлов с галогенами приводит к образованию реактивных соединений, которые имеют важное применение в различных областях химии и промышленности. Такие соединения обладают высокой активностью и используются, например, в производстве фармацевтических препаратов, пластиков и пигментов.
Определение и изучение химических свойств реактивных соединений щелочных металлов с галогенами помогает расширить наши знания о химических взаимодействиях и применении этих веществ в различных отраслях науки и технологии.
Значение реактивных соединений щелочных металлов с галогенами

Реактивные соединения щелочных металлов с галогенами имеют большое значение в химической промышленности и лабораторных исследованиях. Они характеризуются высокой активностью и способностью образовывать стабильные соединения, что делает их полезными в различных процессах.
Важнейшими примерами реактивных соединений являются хлориды, бромиды и иодиды щелочных металлов. Эти соединения обладают высокой растворимостью в воде, что делает их удобными для использования в химическом анализе и синтезе органических соединений.
Другим важным аспектом реактивных соединений щелочных металлов с галогенами является их способность к адсорбции и катализу. Эти соединения могут применяться в процессах очистки газов, различных химических реакциях и каталитических синтезах.
Кроме того, реактивные соединения щелочных металлов с галогенами обладают хорошими антисептическими свойствами и широко применяются в медицине, фармакологии и производстве дезинфицирующих средств.
В целом, реактивные соединения щелочных металлов с галогенами играют важную роль в различных областях промышленности и науки благодаря своей высокой активности, удобству использования и разнообразным химическим свойствам.
Химические свойства реактивных соединений

Реактивные соединения - это химические соединения, которые обладают высокой реактивностью при контакте с другими веществами. Они проявляют интенсивную химическую активность и могут быстро вступать в реакции.
Одной из характеристик реактивных соединений является их способность к окислительно-восстановительным реакциям. Они могут взаимодействовать с другими веществами, отбирая у них электроны или отдавая их. Это делает реактивные соединения важными компонентами для многих промышленных и научных процессов.
Реактивные соединения также могут проявлять высокую реакционную способность с веществами, содержащими различные функциональные группы. Они могут образовывать стабильные или нестабильные соединения с атомами других элементов, что может привести к образованию новых соединений и изменению свойств их исходных компонентов.
Другим важным химическим свойством реактивных соединений является их способность к образованию координационных соединений с различными центральными атомами. В таких соединениях атом реактивного соединения объединяется с атомом другого элемента, образуя сложную структуру. Это может приводить к изменению свойств реактивного соединения и его взаимодействию с другими веществами.
Образование солей при взаимодействии

Соль - это химическое соединение, состоящее из ионов металла и ионов кислоты или основания. При взаимодействии щелочных металлов с галогенами образуется одноименная соль. Данный процесс происходит в результате обменной реакции, при которой ионы металла щелочных металлов замещают водородные атомы в молекулах галогенов.
Например, при реакции натрия с хлором образуется хлорид натрия (NaCl), который представляет собой соль, широко известную под названием поваренная соль. При реакции калия с бромом образуется бромид калия (KBr), который также является солью.
Образование солей при взаимодействии щелочных металлов с галогенами имеет широкое практическое применение. Соли щелочных металлов с галогенами используются в различных областях, включая пищевую промышленность, медицину, производство стекла и многое другое.
Окислительные свойства
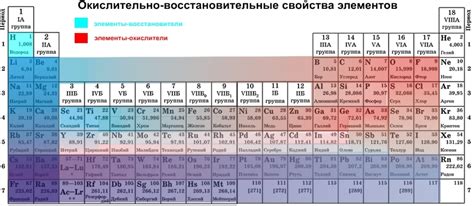
Реактивные соединения щелочных металлов с галогенами обладают высокой окислительной активностью. Это связано с тем, что щелочные металлы имеют низкую электроотрицательность, а галогены - высокую электроотрицательность. Такое сочетание создает благоприятные условия для проявления окислительных свойств реактивных соединений.
Окислительные свойства проявляются в том, что реактивные соединения щелочных металлов с галогенами способны отдавать электроны и окислять другие вещества. При контакте с веществами, которые имеют большую атомную электроотрицательность, такими как неорганические соединения металлов или органические вещества, происходит реакция окисления.
Окислительные свойства реактивных соединений щелочных металлов с галогенами проявляются также в реакциях с водой. При контакте с водой образуется щелочное галогенидное растворимые вещества и высвобождается водород. Эти реакции протекают с высокой интенсивностью из-за окислительной активности соединений.
Окислительные свойства реактивных соединений щелочных металлов с галогенами также проявляются в реакциях с металлами. Они способны окислять металлы, вытесняя их из их соединений и образуя сами галогениды металлов. Этот процесс происходит с выделением энергии и может вызывать воспламенение или взрывы.
Железы промежуточных соединений щелочных металлов с галогенами

Промежуточные соединения щелочных металлов с галогенами играют важную роль в многих химических реакциях. В этих соединениях щелочный металл образует промежуточную ступень до образования ионов металла и галогена.
Промежуточные соединения обладают рядом интересных и полезных свойств. Они могут быть использованы в синтезе органических соединений, в качестве катализаторов, а также как реактивы в различных процессах.
Одним из примеров промежуточного соединения щелочного металла с галогеном является пербромат щелочного металла. Это соединение обладает высокой реакционной способностью и может быть использовано для окисления органических соединений.
Другим примером железы промежуточных соединений является трибромид щелочного металла. Это соединение является мощным окислителем и может быть использовано для окисления различных веществ, включая неорганические и органические соединения.
Вопрос-ответ

Какие химические свойства имеют реактивные соединения щелочных металлов с галогенами?
Реактивные соединения щелочных металлов с галогенами обладают высокой реакционной способностью и химической активностью. Они образуют соль галогенида щелочного металла, которая хорошо растворима в воде и обладает сильными ионными связями. Такие соединения обычно имеют высокую температуру плавления и кипения. Они также обладают хорошей электропроводностью и образуют ионные решения в воде.
Какие реакции происходят при взаимодействии щелочных металлов с галогенами?
При взаимодействии щелочных металлов с галогенами происходят реакции образования солей галогенида щелочного металла. Например, взаимодействие натрия с хлором приводит к образованию хлорида натрия, взаимодействие калия с бромом - к образованию бромида калия. Эти реакции обычно происходят при высоких температурах и с выделением большого количества тепла. Они являются экзотермическими.
Как можно использовать реактивные соединения щелочных металлов с галогенами в промышленности?
Реактивные соединения щелочных металлов с галогенами имеют широкое применение в промышленности. Например, хлор и галогениды щелочных металлов используются в производстве пластмасс, удобрений, промышленных реагентов и очистке воды. Бром и его соединения применяются в производстве фоточувствительных материалов, огнетушителей и лекарственных препаратов. Фтор используется в процессе атомной энергетики и в производстве электроники.
