Атомы щелочноземельных металлов - это элементы, которые находятся во второй группе периодической системы Менделеева. Как и другие элементы, атомы щелочноземельных металлов состоят из ядра, которое содержит протоны и нейтроны, а также электронной оболочки, в которой находятся электроны. Но что именно делает электронную формулу атома щелочноземельного металла уникальной и интересной?
Одной из особенностей электронной формулы атома щелочноземельного металла является его внешняя электронная оболочка. Она состоит из двух электронов, которые находятся в самом внешнем энергетическом уровне - s-орбитали. Это делает атомы щелочноземельных металлов очень реактивными и легкими в химических реакциях. Они легко отдают свои два электрона и образуют ионы с положительным зарядом.
Строение электронной формулы атома щелочноземельного металла также отражает его положение в периодической системе. Атомы щелочноземельных металлов имеют общую формулу ns^2, где n - номер энергетического уровня. Это означает, что атомы таких металлов имеют два электрона в сетчатке s-орбитали, которая является самой близкой к ядру и имеет наименьшую энергию.
Интересный факт: щелочноземельные металлы очень реактивны и легко горят на воздухе. Это связано с их электронной конфигурацией - наличием двух электронов в внешней оболочке, которые легко передаются окружающим атомам.
Строение атома щелочноземельного металла

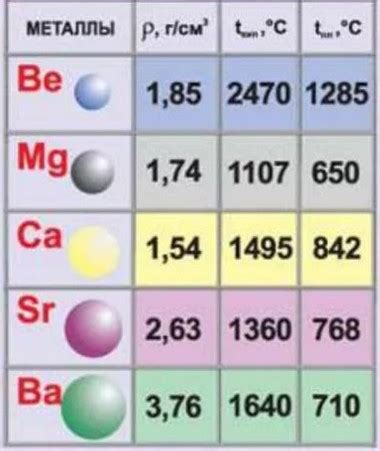
Щелочноземельные металлы включаются во вторую группу периодической системы и состоят из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Атом щелочноземельного металла имеет определенное строение и особенности, которые обуславливают его химические и физические свойства.
Атом щелочноземельного металла состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, на которой расположены электроны. Ядро атома содержит положительно заряженные протоны и нейтроны, которые представляют основную массу атома и определяют его химические свойства.
Электронная оболочка атома щелочноземельного металла состоит из энергетических уровней, на которых располагаются электроны. Внутренний уровень содержит 2 электрона, следующий - 8 электронов, и так далее. Общее число электронов в атоме равно числу протонов в ядре, так как атом является электрически нейтральным.
Строение атома щелочноземельного металла определяет его особенности. Во-первых, электроны на внешнем энергетическом уровне обладают относительно невысокой энергией, что делает эти металлы хорошими восстановителями и обладающими химической активностью. Во-вторых, благодаря своей малой энергии и большому размеру, щелочноземельные металлы имеют низкую температуру плавления и кипения, что делает их мягкими и легкоплавкими.
Таким образом, строение атома щелочноземельного металла играет ключевую роль в химических и физических свойствах этих элементов.
Электронная оболочка атома щелочноземельного металла
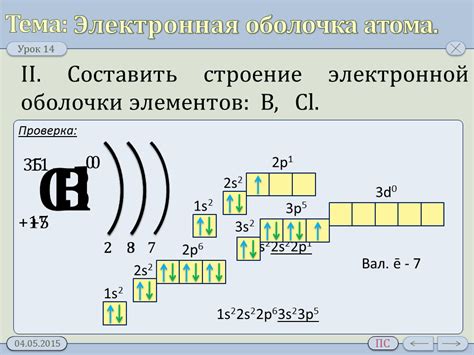
Электронная оболочка атома щелочноземельного металла состоит из электронов, вращающихся вокруг ядра атома. Она состоит из нескольких энергетических уровней, на которых располагаются электроны в соответствии с правилами заполнения.
Первый энергетический уровень содержит 2 электрона, а второй - 8. Именно эти электроны являются валентными электронами, участвующими в химических реакциях с другими элементами.
По правилу Хунда, электроны располагаются на энергетических уровнях таким образом, чтобы минимизировать энергию системы. Таким образом, первый энергетический уровень заполняется полностью, а второй - частично.
Атомы щелочноземельных металлов, таких как бериллий, магний, кальций, стронций и барий, имеют две валентные электронные оболочки. Вторая электронная оболочка характеризуется наличием двух валентных электронов.
Валентность атома щелочноземельного металла
Валентность атома щелочноземельного металла определяется его электронной формулой. Строение электронных оболочек атомов влияет на количество электронов, доступных для взаимодействия с другими атомами. Валентность показывает, сколько электронов атом может отдать или принять при образовании химических связей.
Атомы щелочноземельных металлов имеют две электронных оболочки: внутреннюю s-оболочку и внешнюю p-оболочку. Валентность атома щелочноземельного металла равна двум, так как он может отдать два электрона из своей внешней оболочки.
При образовании химических связей атомы щелочноземельных металлов обычно теряют два электрона и образуют положительные ионы с зарядом +2. Такие ионы обладают положительным зарядом и легко образуют ионные соединения с атомами других элементов, особенно с атомами халькогенов.
Валентность атома щелочноземельного металла является ключевым фактором, определяющим его химические свойства и способность образования соединений. Щелочноземельные металлы, такие как магний, кальций и барий, широко применяются в различных отраслях промышленности и находят свое применение в разных сферах жизни.
Электронное распределение в атоме щелочноземельного металла

Щелочноземельные металлы относятся к группе элементов, которые находятся во второй группе периодической системы. В их атомах оболочку n содержит от 2 до 8 электронов, где n - номер вещества по порядку в периодической системе.
У атомов щелочноземельных металлов внешняя оболочка содержит два электрона. Это означает, что у этих металлов 2 валентных электрона. Такое электронное распределение делает их нестабильными и готовыми к реакции с другими элементами.
Для представления распределения электронов в атоме щелочноземельного металла можно использовать электронную формулу. Электронная формула записывается в виде обозначения оболочек и подобного списку, где каждый элемент представляет собой оболочку с определенным количеством электронов.
Например, для атома магния (Mg) электронная формула будет выглядеть как 1s2 2s2 2p6 3s2. Это означает, что атом магния имеет 2 электрона на первой оболочке, 8 электронов на второй оболочке и 2 электрона на третьей оболочке.
Таким образом, электронное распределение в атоме щелочноземельного металла характеризуется наличием 2 валентных электронов и специфической электронной формулой, которая отражает количество электронов на каждой оболочке.
Особенности электронной формулы атома щелочноземельного металла

Электронная формула атома щелочноземельного металла описывает расположение электронов в энергетических уровнях атома данного металла. Щелочноземельные металлы включают в себя элементы, которые расположены во второй группе периодической системы, а именно: бериллий, магний, кальций, стронций, барий и радий.
Основная особенность электронной формулы атома щелочноземельного металла заключается в наличии двух электронов в валентной оболочке. Волевыми электронами называются электроны, находящиеся в самой внешней оболочке атома. У щелочноземельных металлов в валентной оболочке находятся два электрона, что делает их особенно реактивными и способными образовывать ионы с положительным зарядом.
Другая особенность электронной формулы щелочноземельных металлов заключается в наличии второй энергетической оболочки, являющейся заполненной. Вторая оболочка вмещает максимум 8 электронов, однако в атомах щелочноземельных металлов на этой оболочке находятся только два электрона, что оставляет возможность осуществления химических реакций соединениями ионов щелочноземельных металлов.
Кроме того, электронная формула атома щелочноземельных металлов также указывает на наличие полностью заполненной первой энергетической оболочки. Первая оболочка может вмещать максимум 2 электрона, что означает, что атомы щелочноземельных металлов имеют на этой оболочке полностью заполненный комплект электронов.
Свойства щелочноземельных металлов, определяемые электронной формулой атома

Электронная формула атома щелочноземельного металла позволяет определить его основные свойства и поведение в химических реакциях. Щелочноземельные металлы - это элементы второй группы периодической системы, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Ключевым свойством щелочноземельных металлов, определяемым их электронной формулой атома, является наличие двух внешних электронов в s-орбитали. Это делает эти металлы очень реактивными и способными образовывать химические связи с другими элементами.
Именно благодаря электронной формуле атома щелочноземельные металлы проявляют свойства хороших восстановителей и легко отдают свои электроны, образуя ион положительного заряда. Эта способность делает их хорошими реагентами во многих химических процессах.
Энергия ионизации щелочноземельных металлов, определяемая электронной формулой атома, обычно невысокая, поэтому процесс отдачи электрона происходит сравнительно легко. Кроме того, размер атомов щелочноземельных металлов увеличивается от бериллия к радию, что также влияет на их химические свойства.
Важно отметить, что электронная формула атома щелочноземельного металла определяет его металлический характер, что проявляется в высокой теплопроводности, электропроводности и пластичности. Кроме того, щелочноземельные металлы обладают хорошей способностью растворяться в растворителях и реагировать с водой.
Практическое применение электронной формулы атома щелочноземельного металла

Электронная формула атома щелочноземельного металла является важным инструментом для понимания его строения и особенностей. Она позволяет определить количество электронов во внешней электронной оболочке атома, что существенно влияет на его химические свойства.
Одним из практических применений электронной формулы щелочноземельного металла является определение его восстановительной активности. Атомы щелочноземельных металлов имеют два электрона в внешней s-подобной оболочке, что делает их отличными восстановителями. Это означает, что они легко отдают эти электроны, образуя положительно заряженные ионы и участвуя в различных химических реакциях.
Другое практическое применение электронной формулы атома щелочноземельного металла связано с определением его способности образовывать катионы. Благодаря наличию двух электронов в внешней оболочке, атомы щелочноземельных металлов легко отдают эти электроны, образуя положительно заряженные ионы. Это свойство делает их полезными в различных процессах, включая катализ реакций и создание специфических химических соединений.
Также электронная формула атома щелочноземельного металла используется для определения его электронной конфигурации. Зная количество электронов в каждой электронной оболочке, можно определить его внутреннюю структуру и предсказать его химические свойства и реакционную способность.
В конечном счете, практическое применение электронной формулы атома щелочноземельного металла помогает в понимании и изучении химических свойств и реактивности этих металлов. Она является неотъемлемой частью химического анализа и прогнозирования и позволяет оптимизировать процессы производства и использования щелочноземельных металлов в различных областях науки и промышленности.
Вопрос-ответ

Как строится электронная формула атома щелочноземельного металла?
Электронная формула атома щелочноземельного металла строится на основе количества электронов в его электронных оболочках. Эти металлы, как правило, имеют две электронные оболочки - внутреннюю s-оболочку и внешнюю p-оболочку, которая содержит два электрона. В электронной формуле атома щелочноземельного металла сначала указывается символ химического элемента, затем внизу пишется число 2 для обозначения заполненной s-оболочки, а над символом элемента пишется число 2 для обозначения двух электронов в внешней p-оболочке. Например, электронная формула атома магния будет выглядеть как Mg: 2s2 2p6.
Какие особенности имеет электронная формула атома щелочноземельного металла?
Электронная формула атома щелочноземельного металла имеет несколько особенностей. Во-первых, эти металлы имеют полностью заполненную s-оболочку, которая содержит 2 электрона. Во-вторых, внешняя p-оболочка, в которой находятся электроны щелочноземельных металлов, содержит 2 электрона. Также стоит отметить, что атомы щелочноземельных металлов имеют низкую электроотрицательность и способны образовывать два положительных иона при потере двух электронов из внешней p-оболочки.
Что происходит с электронами во время образования ионов щелочноземельных металлов?
Во время образования ионов щелочноземельных металлов происходит потеря двух электронов из внешней p-оболочки. Эти металлы имеют сильную тенденцию к образованию положительных ионов с 2+ зарядом. Потеря электронов приводит к заполнению внешней оболочки и созданию стабильной электронной конфигурации, которая соответствует электронной формуле атома щелочноземельного металла.
