Эквивалентная масса металла при сгорании - это важная характеристика, позволяющая определить количество вещества металла, необходимого для полного сгорания. Это понятие имеет большое значение в химических расчетах и позволяет оптимизировать процессы, связанные с использованием металлов в различных сферах науки и промышленности.
Определение эквивалентной массы металла при сгорании основывается на массе металла, который сгорает полностью и реагирует с кислородом. Для определения эквивалентной массы металла используется обычно соотношение массы металла к количеству кислорода, участвующего в реакции сгорания.
Точное определение эквивалентной массы металла при сгорании требует проведения экспериментальных исследований. В ходе этих исследований необходимо определить массу металла и кислорода до и после реакции сгорания, а также провести оценку ошибок измерения. После этого можно вывести формулу для расчета эквивалентной массы металла и использовать ее для дальнейших расчетов и рекомендаций по использованию металла в различных процессах.
Эквивалентная масса металла при сгорании

Эквивалентная масса металла при сгорании - это величина, которая позволяет определить количество металла, который участвует в химической реакции с горением. Она выражается в граммах и указывает на массу металла, которая реагирует с определенным количеством кислорода или другого окислителя.
Для определения эквивалентной массы металла при сгорании необходимо знать химическую формулу металла и уравнение реакции соответствующего окисления. Например, для определения эквивалентной массы железа (Fe) при сгорании с кислородом (O2), уравнение реакции будет следующим:
4Fe + 3O2 -> 2Fe2O3
Из этого уравнения видно, что кислород вступает в реакцию с железом в соотношении 3:4. Следовательно, эквивалентная масса железа равна массе железа, деленной на это соотношение. Например, если известно, что масса железа, которое сгорает, составляет 64 г, то эквивалентная масса железа будет равна 64 г / (3/4) = 85.33 г.
Из определения эквивалентной массы металла при сгорании видно, что она зависит от соотношения реагирующих веществ в уравнении реакции. В различных химических реакциях эквивалентная масса металла может быть разной, поэтому необходимо учитывать конкретные условия реакции при определении этой величины.
Таким образом, знание эквивалентной массы металла при сгорании позволяет более точно расчитывать количество металла, необходимого для проведения химических реакций или процессов, связанных с его окислением в вещество.
Что такое эквивалентная масса металла?
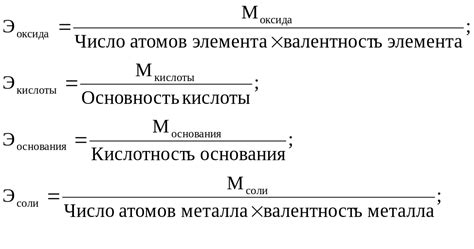
Эквивалентная масса металла - это величина, которая определяет количество вещества металла, необходимого для образования или реакции с другими веществами.
Определение эквивалентной массы металла необходимо при проведении различных реакций, например, сгорания или окислительно-восстановительных процессов. Для определения эквивалентной массы учитывается количество электронов, которые совершают металлический ион в реакции.
Эквивалентная масса металла определяется как отношение молярной массы металла к количеству электронов, участвующих в реакции. Эта величина выражается в г/экв.
Чтобы рассчитать эквивалентную массу металла, необходимо знать молярную массу металла и количество электронов, передающихся в реакции. Далее, просто поделив молярную массу на количество электронов, можно получить эквивалентную массу металла.
Почему важно определить эквивалентную массу металла при сгорании?

Определение эквивалентной массы металла при сгорании имеет большое значение в химических исследованиях и индустриальных процессах. Эта величина позволяет установить точные пропорции между металлом и реагентами, а также позволяет оценить степень его окисления или восстановления.
Знание эквивалентной массы металла при сгорании необходимо при проведении химических реакций, где активное участие принимают металлы или вещества, содержащие металлы. Это помогает определить количество реагентов, необходимых для достижения полного окисления металла или его полного восстановления.
В промышленности определение эквивалентной массы металла при сгорании позволяет установить эффективность и экономичность процессов производства. Правильное определение этой характеристики позволяет улучшить качество продукции, выбрать оптимальные условия работы оборудования и повысить энергоэффективность процесса сгорания.
Кроме того, знание эквивалентной массы металла при сгорании играет важную роль в экологической оценке химических процессов. Она позволяет оценить количество токсичных веществ, образующихся в результате сгорания металлов, и принять меры по их утилизации или нейтрализации, в целях минимизации воздействия на окружающую среду.
Как определить эквивалентную массу металла?

Эквивалентная масса металла является важным показателем, позволяющим определить количество вещества, необходимого для проведения химических реакций. Чтобы определить эквивалентную массу металла, необходимо учесть его атомную массу и степень окисления в реакции сгорания.
В первую очередь, нужно определить атомную массу металла, которая обычно указана в периодической системе химических элементов. Затем следует установить степень окисления металла в реакции сгорания. Степень окисления можно определить по электронной конфигурации атома металла и его способности отдавать или принимать электроны.
Далее, используя соотношение между атомной массой и степенью окисления, можно определить эквивалентную массу металла. Эквивалентная масса выражается в граммах и рассчитывается по формуле: эквивалентная масса = атомная масса / степень окисления.
Например, для определения эквивалентной массы железа в реакции сгорания необходимо знать его атомную массу (Fe = 55.845 г/моль) и степень окисления (обычно +2 или +3). Подставляя значения в формулу, получаем эквивалентную массу железа: (55.845 г/моль) / (2 или 3) = 27.922 г/моль или 18.615 г/моль.
Имейте в виду, что эквивалентная масса металла может изменяться в зависимости от конкретной реакции сгорания и степени окисления. При проведении лабораторных экспериментов рекомендуется использовать точные значения атомных масс и проводить расчеты для каждой конкретной ситуации.
Методы определения эквивалентной массы металла

Определение эквивалентной массы металла при сгорании может осуществляться различными методами. Один из них - визуальный метод. Он заключается в наблюдении за процессом сгорания металла и последующем измерении массы образовавшегося оксида металла.
Другой метод - гравиметрический. Он основан на взвешивании металлической пробки до и после сгорания. Разность масс будет равна массе оксида металла.
Также существует метод количественного анализа по Гейнциусу-Шлема. Он заключается в растворении сгоревшей металлической пробки в кислоте, а затем выделяют образовавшуюся соль. Масса соли определяется весом, а затем с помощью стехиометрического уравнения вычисляют эквивалентную массу металла.
Еще один метод - водородный. Он заключается в пропущении водорода через оксид, предварительно разложив его на металл и кислород. Затем через щелочку измеряют объем выделившегося водорода, а на основе уравнения реакции рассчитывают эквивалентную массу металла.
Иногда применяется полуокислительный метод. В этом случае определяется масса сгоревшего металла, превращенного в оксид, а также масса потраченного на реакцию оксиданта. Исходя из реакционного уравнения, определяют эквивалентную массу металла.
Значение эквивалентной массы металла для химических расчетов

Эквивалентная масса металла является важным понятием в химических расчетах. Она определяет количество вещества данного металла, которое обладает той же реакционной способностью, что и один моль водорода.
Знание эквивалентной массы металла позволяет вести точные и эффективные химические расчеты, особенно при решении задач по количественному анализу. Это важно для определения массы металла, которая участвует в реакции с другими веществами.
Определение эквивалентной массы металла обычно основывается на соотношении числа молей водорода и числа молей металла в реакции. Для примера, если образование оксида металла сопровождается выделением одного моля водорода, то эквивалентная масса металла будет равна его атомной массе.
Эквивалентная масса металла может быть полезна при расчетах, связанных с электролизом, определением концентрации раствора или вычислением массы отложений на электроде. Она также используется при решении задач, связанных с реактивностью металлов и их реакциями с другими веществами.
Вопрос-ответ

Как определить эквивалентную массу металла при сгорании?
Эквивалентная масса металла при сгорании определяется путем измерения количества вещества металла, участвующего в реакции сгорания. Это количество вещества можно определить с помощью химических расчетов, основанных на массе и составе реагирующих веществ.
Какие методы используются для определения эквивалентной массы металла при сгорании?
Для определения эквивалентной массы металла при сгорании могут использоваться различные методы, включая взвешивание реагирующих веществ перед и после реакции, анализ полученных продуктов сгорания, использование стехиометрических соотношений и химических расчетов.
Можно ли определить эквивалентную массу металла при сгорании без проведения химических расчетов?
В некоторых случаях, для определения эквивалентной массы металла при сгорании не требуется проводить сложные химические расчеты. Например, если известны масса металла и масса продуктов сгорания, можно использовать простую формулу для определения эквивалентной массы.
Какая величина является эквивалентной массой металла при сгорании?
Эквивалентная масса металла при сгорании - это масса металла, которая реагирует с определенным количеством кислорода для образования определенного количества оксида металла. Эта величина может быть разной для разных металлов и рассчитывается с использованием стехиометрии и молекулярных масс реагирующих веществ.
