Оксиды металлов - это химические соединения, которые образуются при соединении металла с кислородом. Одной из характерных реакций оксидов металлов является их взаимодействие с водой. При контакте с водой оксиды металлов могут образовывать гидроксиды, которые часто применяются в различных областях, включая промышленность и медицину.
Некоторые металлы обладают способностью образовывать гидроксиды при контакте с водой. К ним относятся металлы, такие как натрий (Na), калий (K), кальций (Ca), магний (Mg), алюминий (Al) и другие. Эти металлы reagují с водой с образованием соответствующих гидроксидов и выделением водорода.
Реакция оксидов металлов с водой является экзотермической, то есть выделяется тепло. В результате реакции образуются гидроксиды соответствующих металлов и молекулярный водород. Некоторые гидроксиды металлов обладают основными свойствами и широко используются в процессе нейтрализации кислот и регулирования кислотно-щелочного баланса.
Примером реакции образования гидроксида металла из его оксида является реакция образования гидроксида натрия (NaOH) из оксида натрия (Na2O). Для этого достаточно поместить оксид натрия в воду, и произойдет образование гидроксида натрия и выделение молекулярного водорода.
Реакция оксидов металлов с водой является важным процессом в химии и имеет широкое применение. Изучение этого процесса помогает нам лучше понять свойства и поведение различных металлов.
Оксиды металлов и их свойства
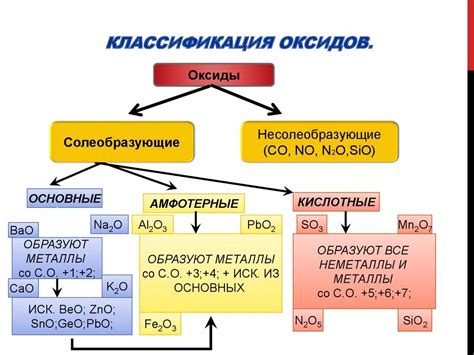
Оксиды металлов являются неорганическими соединениями, которые образуются при реакции металла с кислородом. Эти соединения являются основными компонентами земной коры и имеют широкий спектр свойств.
Одним из основных свойств оксидов металлов является их химическая активность. Многие оксиды металлов обладают способностью реагировать с водой, образуя гидроксиды. Однако не все металлы образуют гидроксиды при взаимодействии с водой.
Оксиды металлов могут быть как основными, так и амфотерными. Основные оксиды обладают щелочными свойствами и растворяются в воде с образованием гидроксидов. Примеры таких оксидов: оксид натрия (Na2O) и оксид калия (K2O).
Амфотерные оксиды, в свою очередь, могут проявлять как кислотные, так и щелочные свойства. Они могут реагировать не только с водой, но и с кислотами или основаниями. Примерами амфотерных оксидов могут служить оксиды алюминия (Al2O3), цинка (ZnO) и железа (Fe2O3).
Также следует отметить, что свойства оксидов металлов зависят от степени окисления металла. Некоторые оксиды могут обладать различными степенями окисления и соответственно различаться по своим свойствам.
Гидроксиды металлов и их образование

Гидроксиды металлов представляют собой соединения, образующиеся при реакции оксидов металлов с водой. Эти соединения широко используются в промышленности и имеют значительное значение в химической и фармацевтической отраслях.
Образование гидроксидов происходит в результате химической реакции, при которой металлический оксид реагирует с молекулами воды. В результате этой реакции образуются гидроксиды металлов и высвобождается энергия. Реакция может протекать с различной степенью интенсивности в зависимости от химических свойств оксида металла и условий реакции.
Гидроксиды металлов обладают рядом характерных свойств. Они обычно являются твердыми веществами, растворимыми в воде, что позволяет использовать их в качестве оснований. Многие гидроксиды обладают щелочными свойствами и используются в процессе нейтрализации кислотных растворов.
Некоторые металлы образуют гидроксиды более активно, чем другие. К таким металлам относятся натрий, калий, гидроксиды которых являются сильными основаниями и активно используются в различных промышленных процессах. Однако, есть и металлы, образующие менее активные гидроксиды, например, железо или цинк.
Гидроксиды металлов имеют широкий спектр применений, от использования в качестве катализаторов в химическом производстве до применения в качестве добавок в фармацевтических препаратах. Эти соединения играют важную роль во многих отраслях промышленности и науки.
Влияние электроотрицательности на реакцию с водой

Электроотрицательность – это химическая характеристика атома или иона, которая определяет его способность притягивать электроны в химической связи. Влияние электроотрицательности на реакцию металлов с водой можно объяснить следующим образом.
Вода является полярным соединением, так как молекула воды состоит из атома кислорода, обладающего большей электроотрицательностью, и двух атомов водорода. Когда металл реагирует с водой, его электроотрицательность влияет на саму реакцию и образование гидроксида металла.
Металлы с низкой электроотрицательностью, такие как натрий и калий, образуют гидроксиды более активно, так как они способны легко отдавать электроны. В результате реакции металла с водой образуется щелочь – гидроксид металла, при этом выделяется водород.
Металлы с более высокой электроотрицательностью, например, алюминий и железо, образуют гидроксиды менее активно, так как они более сильно удерживают свои электроны. Реакция этих металлов с водой происходит медленнее и не так интенсивно, как у щелочных металлов.
Таким образом, электроотрицательность играет важную роль в реакциях металлов с водой. Чем ниже электроотрицательность у металла, тем активнее он реагирует с водой, образуя гидроксид и выделяя водород.
Примеры металлов, образующих гидроксиды
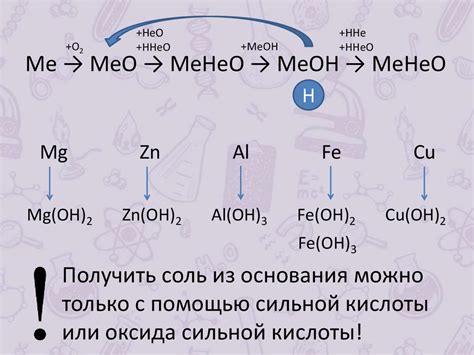
Многие металлы обладают способностью образовывать гидроксиды при реакции с водой. Гидроксиды являются соединениями, состоящими из металла и гидроксильной группы OH-. Наиболее распространенными примерами металлов, которые образуют гидроксиды, являются щелочные металлы - натрий (Na), калий (K), литий (Li) и ртуть (Hg).
Натрий (Na) - металл из группы щелочных металлов, образует гидроксид натрия (NaOH), который широко используется в различных отраслях промышленности. Гидроксид натрия является сильной щелочью и используется в процессах очистки воды, производстве мыла, стекла и других химических соединений.
Калий (K) - еще один щелочной металл, образует гидроксид калия (KOH), который также имеет широкие применение в промышленности. Гидроксид калия используется в производстве удобрений, батареек, мыла и других химических соединений.
Литий (Li) - один из наименее плотных металлов, также образует гидроксид лития (LiOH). Гидроксид лития используется в производстве литий-ионных аккумуляторов, медицине и стекле.
Ртуть (Hg) - насыщенный белый металл, образует гидроксид ртути (Hg(OH)2). Гидроксид ртути редко используется самостоятельно, но может быть продуктом других химических реакций, включая реакцию ртути с кислородом и водой.
Однако это лишь некоторые примеры металлов, образующих гидроксиды при реакции с водой. Существует множество других металлов, которые могут образовывать гидроксиды, и каждый из них имеет свои особенности и применение.
Практическое применение гидроксидов металлов

Гидроксиды металлов находят широкое применение в различных отраслях промышленности и научных исследованиях. Они используются как основные или дополнительные компоненты в производстве различных химических соединений.
Один из основных практических примеров использования гидроксидов металлов - это их применение в качестве щелочных растворителей и реагентов в химической промышленности. Например, гидроксид натрия (NaOH), также известный как каустическая сода, используется в производстве мыла, бумаги, стекла и других продуктов. Гидроксид калия (KOH) применяется в производстве удобрений, мыла и в различных химических синтезах.
Гидроксиды металлов также находят применение в качестве катализаторов или катализаторов в различных процессах. Гидроксид кальция (Ca(OH)2) используется в процессе обеззараживания воды, а гидроксид железа (Fe(OH)3) может применяться в обработке сточных вод или очистке нефтепродуктов.
Кроме того, гидроксиды металлов используются в лабораторных исследованиях, в основном в качестве pH-регуляторов или титрантов. Они также могут быть использованы в медицинских препаратах или косметических средствах в виде активных ингредиентов для лечения или очищения кожи. Например, гидроксид алюминия (Al(OH)3) используется в лекарствах против изжоги.
Таким образом, гидроксиды металлов имеют широкий спектр практического применения, как в промышленности, так и в научных исследованиях. Они являются важными компонентами многих химических процессов и продуктов, играющими важную роль в нашей повседневной жизни.
Вопрос-ответ

Какие металлы могут образовывать гидроксиды при реакции с водой?
Многие металлы могут образовывать гидроксиды при реакции с водой. Некоторые из них включают щелочные металлы, такие как натрий (Na), калий (K) и литий (Li), а также щелочноземельные металлы, такие как бериллий (Be), магний (Mg), кальций (Ca) и стронций (Sr). Другие образующие гидроксиды металлы включают алюминий (Al), цинк (Zn), железо (Fe) и алюминий (Al).
Почему только некоторые металлы образуют гидроксиды при реакции с водой, а другие нет?
Образование гидроксидов при реакции металлов с водой зависит от их электрохимической активности. Металлы, которые находятся в верхней части электрохимического ряда, такие как натрий, калий и магний, имеют большую электрохимическую активность и легко реагируют с водой, образуя гидроксиды и высвобождая водород. Металлы, которые находятся в нижней части ряда, такие как железо и цинк, имеют меньшую электрохимическую активность и не реагируют с водой так же быстро или вообще не реагируют. Это связано с их способностью удерживать электроны и формировать стабильные соединения.
