Анодная реакция растворения металла – это процесс, при котором металл переходит в раствор в результате окисления его атомов. Это электрохимическая реакция, которая происходит на поверхности металла в контакте с раствором. Анодная реакция растворения металла тесно связана с процессом коррозии, однако она может быть использована и в других целях.
Механизм анодной реакции растворения металла включает несколько этапов. Сначала на поверхности металла образуется окисленная пленка, которая служит анодом в электролите. Затем происходит распад окисленной пленки, освобождаются ионы металла, которые переходят в раствор. При этом электроны, выделяющиеся при окислении металла, переносятся через внешнюю цепь на катод, где происходит восстановление.
Анодная реакция растворения металла имеет широкое применение в различных областях. Одно из важных направлений – это производство металлов и сплавов. Благодаря анодной реакции растворения металла можно получить чистые металлы, избегая примесей и загрязнений. Кроме того, анодная реакция растворения металла является основой для создания электролизных процессов, которые применяются в химической промышленности и электротехнике.
Анодная реакция растворения металла
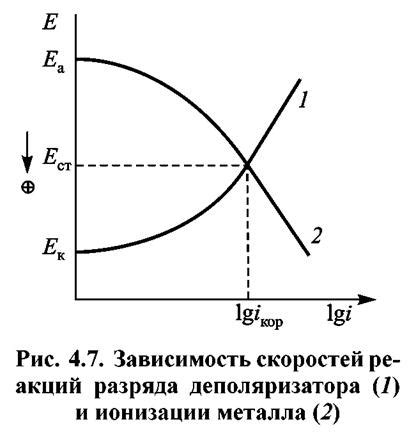
Анодная реакция растворения металла - это процесс окисления металла на аноде, при котором ионы металла переходят в раствор в виде положительно заряженных катионов. В результате этой реакции происходит потеря электронов атомами металла, что приводит к его разрушению и образованию ионов.
Механизм анодной реакции растворения металла может различаться в зависимости от конкретного металла и условий, в которых происходит растворение. Однако, в общем случае процесс анодной реакции состоит из нескольких этапов. Сначала на аноде происходит окисление атомов металла, при котором они отдают свои электроны и становятся ионами. Затем образовавшиеся ионы металла переходят в раствор, где они могут образовывать соединения с другими ионами или молекулами растворителя.
Анодная реакция растворения металла имеет множество применений. Она используется в электрохимических процессах, таких как гальваническая коррозия и электролиз, а также в производстве некоторых химических веществ. Например, анодное растворение металла используется для получения металлических ионов в растворе, которые затем могут быть использованы в качестве катализаторов или сырья для других химических реакций. Также анодная реакция может применяться для очистки металлических поверхностей от оксидных пленок или загрязнений.
Важно отметить, что химическая реакция анодного растворения металла может быть ускорена или замедлена различными факторами, такими как концентрация растворителя, температура, наличие катализаторов или анионов. Поэтому, для эффективного использования анодного растворения металла необходимо учитывать эти условия и проводить оптимизацию процесса.
Механизм реакции
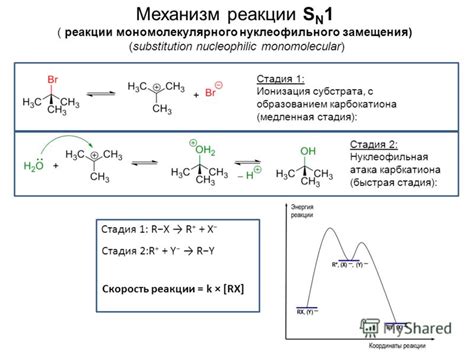
Анодная реакция растворения металла - это процесс, при котором металл окисляется и превращается в ионы, которые растворяются в растворе. Механизм этой реакции может быть разным в зависимости от металла и условий проведения эксперимента.
Один из возможных механизмов анодной реакции растворения металла - это окислительно-восстановительный процесс, при котором металл, будучи окисленным, отдает электроны, а ионы металла переходят в раствор. Это происходит благодаря электрохимическим реакциям, которые происходят на поверхности металла.
Другой возможный механизм реакции - это коррозия металла, которая происходит вследствие взаимодействия металла с окружающей средой. В этом случае возникает электродная пара, состоящая из анода, на который осуществляется растворение металла, и катода, на который переносятся электроны.
Механизм реакции анодного растворения металла может быть исследован с помощью различных физико-химических методов, таких как весовая электрохимия, потенциостатические и потенциостатические методы, спектроскопия и др. Изучение этой реакции имеет практическое значение, поскольку позволяет определить скорость растворения металла, его степень коррозии, а также разработать методы защиты от коррозии и применение металла в различных областях промышленности.
В результате исследования механизма анодной реакции растворения металла можно получить информацию о процессе окисления металла и условиях его проведения, что важно для практических приложений, например, в области производства металлургических изделий, электрохимических элементов и т.д.
Анодные окислители
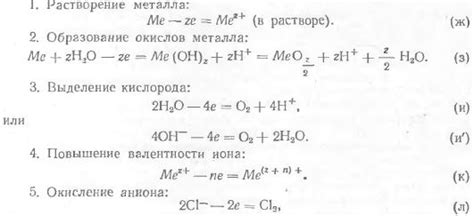
Анодные окислители - это вещества, которые способны принимать электроны от анода при анодной реакции растворения металла. Они играют ключевую роль в процессе электрохимического растворения, обеспечивая электронедостаточному аноду необходимый электронный баланс.
Анодные окислители часто применяются в различных промышленных и научных процессах. Они используются для ускорения скорости растворения металлов, повышения эффективности электролиза и получения высококачественных продуктов. Анодные окислители могут быть использованы в производстве металлов, гальваническом покрытии, электролитическом очистке отходов и других электрохимических процессах.
Примерами анодных окислителей могут быть перекись водорода (H2O2), кислород (O2), хлор (Cl2), бром (Br2) и другие окислители. В зависимости от процесса и требований, выбираются подходящие анодные окислители, учитывая их электрохимические свойства и степень окисления, которую они могут обеспечить.
Анодные окислители играют важную роль в электрохимической промышленности и научных исследованиях. Их правильный выбор и использование позволяет оптимизировать процессы растворения металлов, повысить эффективность и качество продукции, а также снизить затраты на производство.
Коррозия и анодная реакция
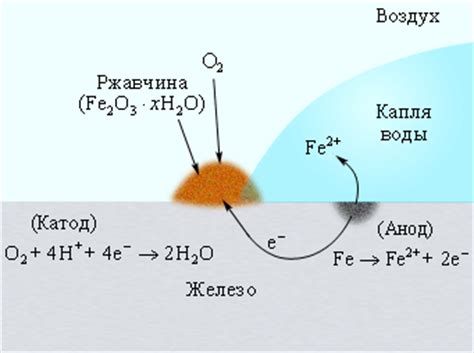
Коррозия - это процесс разрушения и повреждения металлов под воздействием окружающей среды. Одним из основных механизмов коррозии является анодная реакция растворения металла. Анодная реакция представляет собой окислительно-восстановительную реакцию, при которой металл переходит в ионное состояние, образуя положительно заряженные ионы.
В результате анодной реакции металл подвергается растворению, что приводит к появлению коррозии. При этом, анодная реакция сопровождается катодной реакцией, при которой вторичным продуктом является водород или оксид водорода, образующиеся на поверхности металла. Коррозия приводит к потере массы металла, а также к изменению его механических и химических свойств.
Анодная реакция растворения металла имеет большое практическое значение. Она используется в процессах электрохимического осаждения металлов, а также в процессе гальванической коррозии, где металлы с различной степенью активности попадают в контакт друг с другом.
Знание анодных реакций позволяет разрабатывать методы защиты от коррозии, такие как нанесение защитных покрытий на поверхность металла, использование антикоррозионных добавок в покрытиях и другие технологии. А также анодная реакция может быть использована для получения и очистки металлов в промышленности.
Электрохимическая обработка поверхности

Электрохимическая обработка поверхности является эффективным способом изменения свойств материалов. Она основана на использовании электрохимических реакций при прохождении электрического тока через рабочую среду.
Процесс электрохимической обработки поверхности может применяться для очистки, полировки, матирования и покрытия различных материалов. Он позволяет улучшить как эстетические, так и функциональные характеристики поверхности.
Электрохимическая обработка поверхности предоставляет возможность контролировать процессы удаления или добавления материала с высокой точностью. Этот метод позволяет достичь равномерного обработки поверхности, устранить неровности и повреждения.
Применение электрохимической обработки поверхности находится во многих отраслях промышленности, таких как автомобильная, аэрокосмическая, электроника и медицинская. Он широко применяется для создания декоративных покрытий, защиты от коррозии, улучшения адгезии и прочности соединений.
- Полировка
- Матирование
- Гальваническое покрытие
- Очистка от загрязнений
При процессе электрохимической обработки поверхности важна точная регулировка параметров, таких как температура, pH и ток. Она также требует использования специальных оборудования и реагентов, а также соблюдения соответствующих мер безопасности.
Использование анодной реакции
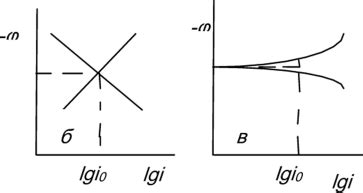
Анодная реакция растворения металла имеет широкое применение в различных областях науки и техники. Эта реакция играет важную роль в электрохимии, гальванике и коррозионных процессах.
Электролиз – это одно из важных применений анодной реакции. Путем применения электрического тока можно специально контролировать анодную реакцию, что позволяет получать металлы с высокой степенью чистоты и проводить электрохимические синтезы различных веществ.
Батареи и аккумуляторы - это также примеры применения анодной реакции. В батареях активный материал на аноде окисляется, освобождая электроны, которые затем перемещаются через внешнюю цепь, питая электрические устройства.
Кроме того, анодная реакция используется в гальванике, где происходит преобразование химической энергии в электрическую. Примером гальванической ячейки является водородный генератор, где анодная реакция – это процесс окисления воды до образования кислорода и анодным материалом является платина.
Еще одним важным применением анодной реакции являются коррозионные процессы. В процессе коррозии металл находится в анодной зоне, где происходит реакция с окружающей средой, что приводит к разрушению и потере материала. Понимание анодных реакций позволяет разрабатывать методы защиты от коррозии и разрабатывать новые материалы с повышенной коррозионной стойкостью.
Защита от коррозии
Коррозия металлов - распространенное явление, которое приводит к их разрушению и повреждению. Однако существуют различные методы, позволяющие защитить металлы от коррозии.
Один из наиболее эффективных способов защиты от коррозии - анодная защита. Её суть заключается в создании электрической системы, в которой металл, подверженный коррозии (анод), превращается в катод. Для этого на анод накладывается ток, который препятствует протеканию анодной реакции растворения металла. В результате металл не окисляется и сохраняет свои свойства.
Анодная защита широко применяется в различных отраслях промышленности и строительстве. Например, она используется для защиты трубопроводов, контейнеров, судов, мостов и других сооружений от коррозии. С помощью анодной защиты можно продлить срок службы металлических конструкций и снизить затраты на их ремонт и замену.
Однако анодная защита имеет свои ограничения. Например, она неэффективна в условиях, когда металл находится в контакте с кислотными или щелочными средами. Также эффективность анодной защиты зависит от качества проводников, соединений и регулярности проверки и обслуживания системы.
В целом, анодная защита является одним из наиболее эффективных методов борьбы с коррозией металлов. Она позволяет сохранить металлы в рабочем состоянии и снизить риски и затраты, связанные с их повреждением.
Применение анодной реакции в промышленности

Анодная реакция растворения металла находит широкое применение в различных отраслях промышленности. Одной из основных областей использования является гальваническая обработка поверхностей. Анодное растворение металла позволяет осуществлять электрохимическое покрытие, а также удаление оксидных пленок и загрязнений с поверхности изделий.
В электрохимической гальванике использование анодной реакции позволяет наносить на поверхность изделий тонкие металлические покрытия с заданными свойствами, такими как стойкость к коррозии, электропроводность и декоративность. Процессы анодного растворения металла также применяются для создания защитных покрытий, например, в автомобильной промышленности.
Анодная реакция может быть использована для очистки поверхностей металлических изделий от оксидных пленок, нагара и загрязнений. Например, при производстве электронной техники используется анодное растворение, чтобы очистить поверхность контактов от оксидных слоев, тем самым обеспечивая надежное электрическое соединение.
Также анодная реакция находит применение в металлургической промышленности для извлечения ценных металлов из их руд. В процессе электролиза металл может быть растворен на аноде, а затем восстановлен на катоде в чистом виде. Это позволяет получать чистые металлические продукты высокой степени очистки.
Вопрос-ответ

Как происходит анодная реакция растворения металла?
Анодная реакция растворения металла происходит при окислении металла, которое сопровождается выделением электронов. Эти электроны передаются через электрод внешней цепи, образуя электрический ток.
Можно ли применять анодное растворение металла в промышленности?
Да, анодное растворение металла имеет широкое применение в промышленности. Например, оно используется для создания электролитических покрытий на различных изделиях из металла, таких как медные провода, алюминиевые детали и т.д. Это позволяет защитить металл от коррозии и улучшить его внешний вид.
Каким образом происходит растворение металла в анодной реакции?
Растворение металла в анодной реакции происходит путем перехода металлических ионов из металла в раствор. При этом происходит окисление металла, а его ионы переносятся в раствор, что приводит к уменьшению размеров металлического образования.
Какие факторы влияют на скорость анодной реакции растворения металла?
Скорость анодной реакции растворения металла зависит от нескольких факторов. Важную роль играет концентрация электролита, температура раствора и плотность тока. Чем выше концентрация электролита, тем выше скорость реакции. Повышение температуры раствора также увеличивает скорость растворения металла. Плотность тока также влияет на скорость реакции: чем выше плотность тока, тем больше металла растворяется в единицу времени.
Какие металлы подвержены анодной реакции растворения?
Анодная реакция растворения металла может происходить с различными металлами. Некоторые из них, такие как цинк, медь, алюминий, свинец и железо, легко растворяются, когда они являются анодами. Другие металлы, такие как золото и платина, обладают большей стойкостью к растворению и не подвержены анодной реакции при обычных условиях.
