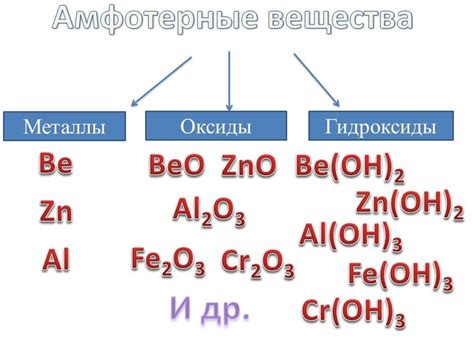
В химии существуют определенные металлы, которые проявляют свойства амфотерных оксидов, то есть способны образовывать соли и соединения как с кислотами, так и с основаниями. Такие металлы называются амфотерными металлами и включают в себя алюминий, железо, цинк и другие.
Степень окисления амфотерных металлов может варьироваться в зависимости от условий окружающей среды. В кислой среде эти металлы образуют соединения с меньшей степенью окисления, где они действуют как кислотные окислители. В щелочной среде они образуют соединения с большей степенью окисления и действуют как основные окислители.
Интересно отметить, что амфотерные металлы обладают также амфотерными гидроксидами, которые образуются в результате их реакции с водой. В кислой среде гидроксиды амфотерных металлов ведут себя как кислоты, а в щелочной - как основания.
Степень окисления, проявляемая амфотерными металлами в различных условиях окружающей среды, делает их универсальными активаторами реакций и широко применяемыми в химии и промышленности. Изучение особенностей степени окисления данных металлов имеет огромное значение для понимания их реакционной способности и возможностей в различных химических процессах.
В итоге, понимание особенностей степени окисления амфотерных металлов важно как для теоретической химии, так и для практического применения этих металлов в различных областях науки и техники.
Что такое амфотерные металлы?
Амфотерными металлами называются химические элементы, которые способны проявлять свойства и характерные реакции как металлов, так и неметаллов. Они обладают способностью взаимодействовать как с кислотами, так и с щелочами, проявляя свойства амфотерности.
Амфотерность металлов означает, что они могут образовывать соли с кислотами и основаниями. Вследствие этого они могут вести себя как окислители и восстановители в химических реакциях.
Амфотерные металлы включают такие элементы, как алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), марганец (Mn) и др. Они имеют широкое применение в различных областях, в том числе в производстве сплавов, электронике, строительстве, а также в качестве катализаторов и лекарственных препаратов.
Свойства амфотерных металлов
Амфотерные металлы обладают способностью проявлять свойства как оснований, так и кислот. Их способность взаимодействовать с кислотами и основаниями обусловлена наличием свободных электронных пар и ионных радикалов.
Амфотерные металлы способны образовывать растворы, в которых могут быть присутствующие различные оксиды и гидроксиды. В зависимости от условий окисления-восстановления, амфотерные металлы могут проявлять свойства кислот в растворах с низким pH и свойства оснований в растворах с высоким pH.
Свойства амфотерных металлов также проявляются в их способности образовывать соединения с различными элементами. Например, они могут соединяться со смешиванием оксида с водой, образуя оксоанионы и гидроксокатионы.
Другим важным свойством амфотерных металлов является их способность к образованию комплексных соединений. Это связано с наличием в их электронной оболочке свободных электронных пар и возможностью образования координационных связей с другими атомами или ионами.
Примеры амфотерных металлов

Амфотерные металлы – это класс веществ, которые могут проявлять как кислотные, так и основные свойства, в зависимости от условий. Их химическая активность зависит от степени окисления.
Примерами амфотерных металлов являются:
- Алюминий (Al): этот металл является одним из наиболее известных амфотерных металлов. Он образует соли и оксиды, которые проявляют и кислотные, и основные свойства. Например, оксид алюминия (Al2O3) может реагировать как с кислотами, так и с щелочами.
- Свинец (Pb): он также является амфотерным металлом. Одним из самых известных соединений свинца является оксид свинца (PbO), который может реагировать как с кислотами, так и с щелочами. Кроме того, свинец может образовывать соли обоих типов.
- Цинк (Zn): хотя цинк обычно проявляет исключительно щелочные свойства, он также может проявлять кислотные свойства в некоторых условиях. Например, некоторые соединения цинка могут реагировать с кислотами.
- Олово (Sn): это еще один пример амфотерного металла. Олово образует соединения, которые реагируют как с кислотами, так и с щелочами. Например, оксид олова (SnO2) может выступать в роли и окислителя, и восстановителя.
Таким образом, амфотерные металлы демонстрируют уникальные свойства, которые позволяют им проявлять и кислотные, и основные характеристики в различных химических реакциях.
Окисление амфотерных металлов

Амфотерные металлы - это металлы, способные проявлять свойства как металла, так и неметалла. Они обладают способностью взаимодействовать не только с кислотами, но и с щелочами. Эта особенность делает амфотерные металлы уникальными, так как они могут изменять свою степень окисления в зависимости от окружающей среды.
Окисление амфотерных металлов происходит в химических реакциях, при которых металл участвует в реакции с кислородом или другими окислителями. В результате окисления металл может образовывать соединения с различными степенями окисления. Например, алюминий может иметь степень окисления +3 в щелочной среде и -3 в кислородсодержащих соединениях.
Окисление амфотерных металлов может происходить как в водных растворах, так и в твердой фазе. В водных растворах окисление металла происходит за счет протекания электрохимических реакций, в результате которых происходит передача электронов. В твердой фазе окисление металла может происходить при взаимодействии с кислородом воздуха.
Использование амфотерных металлов в различных отраслях промышленности обусловлено их уникальными свойствами и способностью изменять степень окисления. Например, алюминий используется в производстве легких и прочных конструкций благодаря своей низкой степени окисления. А такие металлы, как цинк и свинец, находят применение в производстве батарей благодаря своей способности выступать в роли окислителей или восстановителей.
Сте́пень окисле́ния в соедине́ниях с амфоте́рными мета́ллами
Амфоте́рные мета́ллы – это класс металлов, которые могут проявлять как кислотные, так и основные свойства в зависимости от условий окружающей среды. Одной из основных характеристик амфотерных металлов является различие их степени окисления в разных соединениях.
Как правило, амфотерные металлы имеют несколько степеней окисления, которые соответствуют различным соединениям с другими химическими элементами. Например, алюминий (Al) может иметь степень окисления +3 в алюминиевых оксидах и +1 в гидроксидах. При этом, амфотерные металлы образуют кислотные соединения с более низкими степенями окисления и основные соединения с более высокими степенями окисления.
Другим примером амфотерного металла является цинк (Zn), который может иметь степень окисления +2 в соединениях с кислотными свойствами и +1 в соединениях с основными свойствами. Также цинк образует цинкатые и цинкитые соединения с более высокой степенью окисления.
Степень окисления амфотерных металлов играет важную роль в химических реакциях и их взаимодействии с другими веществами. Знание степени окисления позволяет определить химические свойства соединений амфотерных металлов и предсказать их реакционную способность. Также степень окисления является основой для построения структуры и номенклатуры соединений амфотерных металлов.
Применение амфотерных металлов

Амфотерные металлы имеют широкий спектр применения благодаря своей уникальной способности образовывать соединения как с кислотами, так и с щелочами. Это делает их важным компонентом в различных отраслях промышленности и науки.
Один из основных способов использования амфотерных металлов - производство специальных катализаторов. Они играют решающую роль в химических реакциях, ускоряя их протекание и увеличивая выход продукта. Амфотерные металлы, такие как алюминий и цинк, являются основными компонентами таких катализаторов.
Другой областью применения амфотерных металлов является электрохимия. Они используются в аккумуляторах и гальванических элементах, где их способность изменять степень окисления позволяет эффективно выполнять электролитические процессы.
Амфотерные металлы также находят применение в производстве красителей, стекла и керамики. Благодаря способности образовывать оксиды и гидроксиды различной степени окисления, они могут вносить физические и химические изменения в структуру материалов, придавая им желаемые свойства.
Также, амфотерные металлы используются в медицине для создания лекарственных препаратов. Они проявляют антисептические, противовоспалительные и антибактериальные свойства, что делает их ценными компонентами в производстве лекарств и медицинских инструментов.
В целом, применение амфотерных металлов охватывает широкий спектр отраслей и областей, от промышленности до медицины. Их уникальная способность взаимодействовать с кислотами и щелочами делает их ценными компонентами в различных процессах и материалах.
Вопрос-ответ

Какие металлы относятся к амфотерным?
Амфотерными металлами называют металлы, которые могут образовывать и положительные, и отрицательные ионы в процессе химических реакций. К ним относятся алюминий, цинк, железо, медь и другие.
В чем особенность степени окисления амфотерных металлов?
Особенностью степени окисления амфотерных металлов является то, что они могут изменять свою степень окисления в различных условиях. Так, например, алюминий может иметь степень окисления +3 или -3, в зависимости от химической среды.
Какие соединения образуют амфотерные металлы?
Амфотерные металлы могут образовывать различные соединения в зависимости от условий реакции. В щелочной среде они могут образовывать гидроксиды, а в кислой среде - соли с кислотами. Например, алюминий образует гидроксид Al(OH)3 в щелочной среде и соль АlCl3 с хлороводородной кислотой.
Какую роль играют амфотерные металлы в химических реакциях?
Амфотерные металлы играют важную роль в химических реакциях, так как они способны взаимодействовать как с кислотами, так и с щелочами. Благодаря этому они могут образовывать различные соединения и участвовать в разнообразных химических процессах.
