Металлы – это особый класс химических элементов, которые обладают определенными физическими и химическими свойствами. Основным характерным свойством металлов является их способность легко принимать электроны. Однако, не все металлы одинаково принимают электроны. Некоторые элементы из этого класса имеют особые особенности взаимодействия с электронами и обладают специфическими химическими свойствами.
Одной из основных причин, почему металлы легко принимают электроны, является их электронная структура. У этих элементов внешний энергетический уровень (так называемый уровень заполнения) обладает свободным электроном или несколькими свободными электронами. Именно эти электроны обеспечивают металлам их характеристические свойства, такие как хорошая электропроводность, теплопроводность, пластичность и др.
Однако, не все металлы имеют одинаковую способность принимать электроны. Некоторые из них обладают особыми свойствами, которые определяются их химической структурой и межатомными взаимодействиями.
Так, например, некоторые металлы из группы переходных элементов имеют особенности в электронной структуре, благодаря которым они могут образовывать комплексы с другими атомами или ионами. Это позволяет им принимать или отдавать электроны с большей или меньшей легкостью, в зависимости от своего окружения. Такие металлы обладают более сложными химическими свойствами и могут использоваться в различных отраслях науки и техники.
Таким образом, металлы в целом имеют способность легко принимать электроны, но различные элементы этого класса обладают разными химическими свойствами и могут вести себя по-разному в химических реакциях. Изучение электронной структуры и химических свойств металлов помогает не только понять их поведение, но и разработать новые материалы и технологии.
Металлы: электронная проводимость и химический потенциал
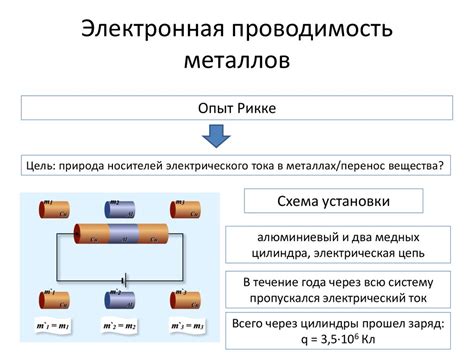
Металлы являются отличными проводниками электричества благодаря особенностям их электронной структуры. У атомов металлов валентная оболочка содержит лишь несколько электронов, что делает их более мобильными и способными свободно передвигаться. Это обуславливает высокую электронную проводимость металлов.
Основным показателем электронной проводимости является химический потенциал металла, который характеризует способность вещества отдавать или принимать электроны. Металлы обладают низким химическим потенциалом, что означает их способность принимать электроны от других веществ. Это обуславливает возникновение реакций окисления металлов, при которых они отдают электроны.
Высокая электронная проводимость и низкий химический потенциал металлов позволяют им легко образовывать ионы, что является основой реакций окисления-восстановления и электрохимических процессов. Благодаря этим свойствам, металлы широко используются в различных сферах, таких как электроника, энергетика, строительство и промышленность.
Какие металлы принимают электроны легко и без проблем?
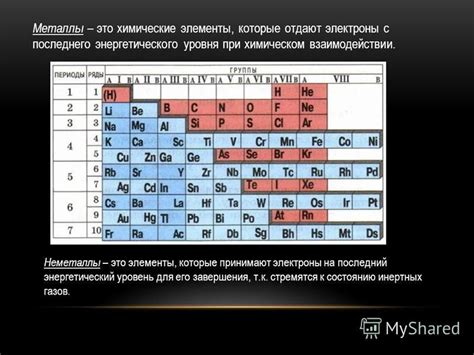
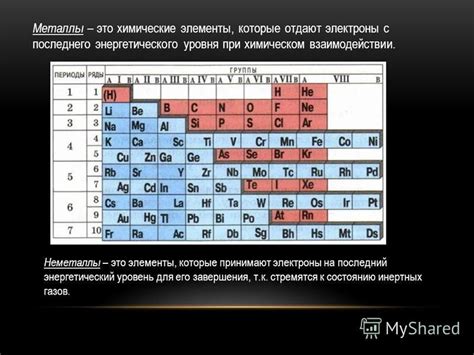
Металлы могут быть разделены на две группы по их способности принимать электроны. Большинство металлов, таких как медь, алюминий и железо, легко принимают электроны и тем самым обладают высокой проводимостью электричества. Они имеют небольшую энергию ионизации, что позволяет им легко отдавать и принимать электроны в реакциях с другими элементами.
Это свойство металлов обусловлено особенностями их электронной структуры. Внешний электронный слой у металлов обычно содержит малое количество электронов (обычно 1-3). Они слабо удерживаются ядром атома и, следовательно, металлы без проблем могут отдавать эти электроны другим элементам, образуя положительные ионы.
Помимо этого, не все металлы обладают одинаковой способностью принимать электроны. Например, щелочные металлы, такие как литий, натрий и калий, имеют наибольшую способность принимать электроны и образовывать отрицательные ионы. Они находятся в самом начале периодической системы элементов и имеют только один электрон в внешнем электронном слое.
Однако, есть и металлы, которые имеют высокую энергию ионизации и поэтому принимают электроны с трудом или не принимают их вообще. Такие металлы, как золото и платина, обладают низкой реактивностью и слабо вступают в химические реакции с другими элементами. Они обычно применяются в ювелирной промышленности и электротехнике из-за своей стабильности и неподвижности.
Металлы с высокой электронной проводимостью

Металлы - это особая категория веществ, которые обладают высокой электронной проводимостью. Они отличаются от других материалов тем, что у них свободные электроны, которые легко перемещаются по всей структуре металла. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Наиболее известные примеры металлов с высокой электронной проводимостью - это медь, алюминий, железо и золото. Медь в особенности известна своей высокой проводимостью и широким применением в электротехнике и электронике. Алюминий также является хорошим проводником и широко применяется в производстве проводов и кабелей.
Процесс проводимости в металлах основан на явлении называемом "электронным облаком". Внутри металла электроны образуют свободную электронную систему, которая перемещается со скоростью света под действием электрического поля. Это облегчает передачу электрического тока и позволяет металлам быть отличными проводниками.
Для металлов с высокой электронной проводимостью характерным свойством является низкое сопротивление прохождению электрического тока. Это позволяет металлам эффективно передавать электричество без затраты большого количества энергии на его преодоление.
Металлы, которые сложно принимают электроны
В мире химических элементов существует множество металлов, некоторые из которых проявляют особую сложность в приеме электронов. Эти металлы обладают определенными свойствами, которые оказывают влияние на их способность взаимодействовать с другими веществами и принимать электроны.
Один из таких металлов – германий. В его атоме имеется 32 электрона, однако он не имеет способности легко принимать электроны. Это связано с тем, что у германия есть семь электронов в «свободном» (внешнем) энергетическом уровне, и он стремится к насыщению этого уровня путем образования ковалентных связей, а не принятия электронов.
Еще одним примером металла, который сложно принимает электроны, является хром. Хром имеет 24 электрона, но обладает высокой энергией своего внешнего уровня. Из-за этого хрому трудно принимать дополнительные электроны и образовывать ионы. Он предпочитает образовывать стабильные соединения через образование ковалентных связей или принимая форму катиона, когда ионизируется.
Также стоит упомянуть о присутствии в природе платины, которая также проявляет сложность в приеме электронов. У платины 78 электронов и их расположение на энергетических уровнях делает ионизацию платины и получение отрицательно заряженных электронов трудными.
Влияние электронной проводимости на свойства металлов
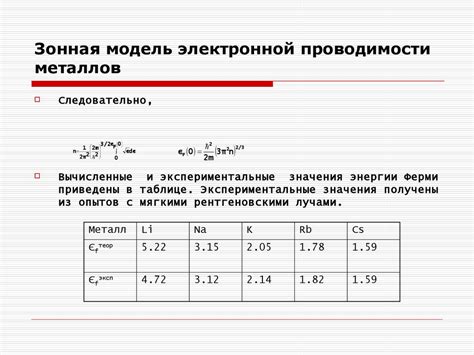
Электронная проводимость является одной из ключевых характеристик металлов, определяющих их свойства. Способность металлов принимать и передавать электроны играет важную роль в их поведении и влияет на различные физические и химические свойства.
Металлы, хорошо проводящие электричество, обладают высокой электронной проводимостью. Именно благодаря этому свойству они являются основой для создания электрических цепей и проводников. Электроны в металлах свободно перемещаются по кристаллической решетке, создавая электронный газ. Это позволяет им передавать электрический ток с минимальным сопротивлением.
Способность металлов к электронной проводимости также влияет на их теплопроводность. Благодаря свободному перемещению электронов, металлы способны эффективно передавать тепло. Это делает их хорошими материалами для изготовления теплопроводящих элементов и радиаторов.
Однако не все металлы обладают высокой электронной проводимостью. Некоторые элементы, например, полуметаллы и полупроводники, обладают относительно низкой проводимостью. Это связано с их особенной электронной структурой, которая не позволяет электронам свободно передвигаться по решетке. Поэтому эти материалы часто применяются в электронике и полупроводниковой промышленности для создания различных устройств и полупроводниковых компонентов.
Вопрос-ответ

Почему некоторые металлы легко принимают электроны, в то время как другие - нет?
Процесс принятия электронов металлами зависит от их внутренней структуры и расположения электронов в энергетических уровнях. Металлы, которые легко принимают электроны, имеют низкую энергию и свободные электронные уровни в своей валентной оболочке. Это позволяет им эффективно взаимодействовать с другими веществами и принимать электроны. В то время как другие металлы имеют высокую энергию и не имеют свободных электронных уровней, что делает процесс принятия электронов более сложным.
Какие факторы влияют на способность металлов принимать электроны?
На способность металлов принимать электроны влияют такие факторы, как их энергетические уровни, количество свободных электронов в валентной оболочке, электроотрицательность элемента и его атомный радиус. Металлы с низкими энергетическими уровнями и наличием свободных электронов в валентной оболочке имеют большую способность принимать электроны. В то же время, металлы с высокими энергетическими уровнями и малым количеством свободных электронов имеют меньшую способность принимать электроны.
Почему некоторые металлы обладают большей способностью принимать электроны, чем другие?
Металлы обладают разной способностью принимать электроны из-за различий в их электронной структуре. Металлы с большим количеством свободных электронов в валентной оболочке и низкой энергией электронных уровней имеют большую способность принимать электроны. Это связано с тем, что у них есть свободные места для электронного принятия и низкая энергия, что способствует возможности фотоионизации. В то же время, металлы с высокой энергией электронных уровней и малым количеством свободных электронов имеют меньшую способность принимать электроны.
