Амфотерные металлы главных подгрупп – это элементы периодической системы, которые в реакциях могут проявлять и кислотные, и основные свойства. Термин "амфотерный" означает, что данные металлы способны реагировать как с кислотами, так и с основаниями, в зависимости от условий взаимодействия. Некоторые из амфотерных металлов главных подгрупп – это алюминий, кремний, олово, свинец, германий, ванадий и др.
Одно из наиболее известных свойств амфотерных металлов главных подгрупп – это их способность образовывать соли с кислотами и основаниями. Они могут выступать в качестве кислотных компонентов, отдавая свои ионы металла в раствор, либо в качестве основных компонентов, принимая ионы металла от кислоты. Например, амфотерные оксиды алюминия и железа реагируют с сильными кислотами и основаниями, образуя соли и воду.
Кроме того, амфотерные металлы главных подгрупп обладают свойством образовывать соединения со сменной степенью окисления. Это означает, что они могут иметь различные степени окисления и образовывать соответствующие соединения. Например, ванилий может иметь окислительные состояния +2, +3, +4 и образовывать соответствующие оксиды и соли.
Таким образом, свойства амфотерных металлов главных подгрупп обусловлены их способностью реагировать как с кислотами, так и с основаниями, и образовывать соединения со сменной степенью окисления. Это делает их очень важными в химической промышленности и использовании в различных процессах и реакциях.
Что такое амфотерные металлы?
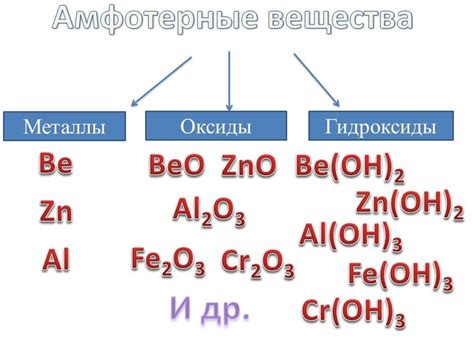
Амфотерные металлы - это класс веществ, которые обладают способностью взаимодействовать как с кислотами, так и с щелочами. Это группа металлов, которые могут проявлять как кислотные, так и щелочные свойства в зависимости от условий взаимодействия. Такое поведение обусловлено их уникальной структурой и электронной конфигурацией.
Амфотерные металлы включают в себя элементы главных подгрупп периодической таблицы, такие как алюминий, галлий, цинк, олово, свинец и др. Они характеризуются наличием свободных электронов во внешней оболочке, что позволяет им принимать и отдавать электроны во время химических реакций.
Амфотерные металлы обладают разнообразными и важными свойствами. Они могут реагировать с кислотами, образуя соли, а также с щелочами, образуя соединения типа гидроксидов. Это свойство делает их полезными в различных областях, включая химическую промышленность, медицину и электронику.
Некоторые амфотерные металлы, такие как алюминий и цинк, обладают антикоррозийными свойствами. Они могут реагировать с кислотами, предотвращая образование коррозии и сохраняя металлическую поверхность в хорошем состоянии. Это делает их востребованными материалами в производстве автомобилей, самолетов и других металлических конструкций.
В таблице 1 приведены примеры амфотерных металлов и их основные свойства:
| Металл | Основные свойства |
|---|---|
| Алюминий | Амфотерное поведение, антикоррозийные свойства, использование в производстве авиационной и электронной техники |
| Цинк | Амфотерное поведение, антикоррозийные свойства, использование в производстве оцинкованной стали и батареек |
| Олово | Амфотерное поведение, использование в производстве припоев и косметических продуктов |
Таким образом, амфотерные металлы представляют собой важный класс веществ с уникальными свойствами, позволяющими им взаимодействовать как с кислотами, так и с щелочами. Их использование в различных областях сделало их незаменимыми материалами в современной технологической индустрии.
Определение и примеры

Амфотерные металлы главных подгрупп - это группа химических элементов, которые могут образовывать как катионы, так и анионы, взаимодействуя с кислотами и щелочами. Такие металлы обладают возможностью проявлять свои амфотерные свойства в разных окружающих средах и при разных условиях.
Некоторые примеры амфотерных металлов главных подгрупп включают алюминий (Al), галлий (Ga) и индий (In). Алюминий, например, может реагировать с различными кислотами, образуя соли, такие как хлорид алюминия (AlCl3) или оксиды, такие как оксид алюминия (Al2O3).
Определение амфотерности металлов главных подгрупп зависит от их электронной структуры и способности образовывать различные типы химических связей. Амфотерные металлы способны изменять свою валентность и окружающую среду во время взаимодействия с кислотами или щелочами, что делает их важными компонентами в различных химических процессах и промышленных приложениях.
Кислотные и щелочные свойства амфотерных металлов главных подгрупп

Амфотерные металлы, относящиеся к главным подгруппам периодической системы химических элементов, обладают способностью проявлять как кислотные, так и щелочные свойства.
Кислотные свойства амфотерных металлов проявляются в реакциях с основаниями, при которых они действуют как кислоты. При этом амфотерные металлы образуют с соответствующими основаниями соли.
Щелочные свойства амфотерных металлов проявляются в реакциях с кислотами, при которых они действуют как основания. При этом амфотерные металлы образуют с соответствующими кислотами соли.
Примером амфотерного металла главной подгруппы является алюминий (Al), который при взаимодействии с кислотами образует соли, а с основаниями действует как кислота.
Также амфотерные металлы могут проявлять свои кислотные и щелочные свойства в реакциях с водой, образуя растворы, которые окрашиваются в кислотный или щелочной цвет в зависимости от их характера.
Вопрос-ответ

Какие металлы относятся к амфотерным?
К амфотерным металлам относятся алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe) и другие. Эти металлы обладают способностью реагировать и с кислотами и с щелочами.
Какие свойства имеют амфотерные металлы?
Основное свойство амфотерных металлов - способность образовывать как соли с кислотами, так и основания с щелочами. Они могут образовывать два типа ионов - положительно заряженные (катионы) и отрицательно заряженные (анионы). Кроме того, амфотерные металлы имеют высокую теплопроводность, хорошую электропроводность и высокую пластичность.
Какие соединения могут образовывать амфотерные металлы?
Амфотерные металлы могут образовывать как кислотные, так и основные соединения в зависимости от условий реакции. Например, алюминий может образовывать соли с кислотами, такие как сульфат алюминия (Al2(SO4)3), а также основания с щелочами, такие как гидроксид алюминия (Al(OH)3). Это свойство делает амфотерные металлы очень полезными в различных химических процессах и промышленных производствах.
