Щелочные металлы - это элементы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью и реактивностью, образуя ионно-молекулярные соединения. Однако, одно из основных свойств, которому обычно приписывают щелочные металлы, это постоянная степень окисления. Однако, насколько это верно?
Постоянная степень окисления означает, что элемент в соединении всегда имеет одну и ту же электрическую зарядность. В случае щелочных металлов, их степень окисления обычно соответствует заряду ионов, которые они образуют. Например, для лития степень окисления составляет +1, для натрия - также +1, а для калия - также +1. Казалось бы, это свидетельствует о постоянной степени окисления для всех щелочных металлов.
Однако, действительно ли это является всегда истиной? Существуют некоторые особенности, которые могут влиять на степень окисления щелочных металлов. Одной из таких особенностей является образование комплексных соединений с другими элементами. В таких соединениях степень окисления щелочных металлов может быть изменена под воздействием различных факторов, таких как окружающая среда, концентрация веществ и температура.
Мифы о постоянной степени окисления щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Великая долина западной Сибири познакомила человечество с этими элементами около 10 тысяч лет назад. С тех пор щелочные металлы были исследованы вдоль и поперек, однако они до сих пор вызывают интерес и волнуют умы исследователей.
Одним из распространенных мифов о щелочных металлах является вера в их постоянную степень окисления. На самом деле, степень окисления щелочных металлов не является постоянной и может варьироваться в различных соединениях. Например, литий может иметь степень окисления +1 в большинстве своих соединений, но в пероксидах и супероксидах он имеет степень окисления +2 и +1, соответственно. Натрий обычно имеет степень окисления +1, но в некоторых соединениях его степень окисления может быть и разной.
Еще одним мифом о щелочных металлах является утверждение о том, что они всегда проявляют исключительно положительные степени окисления. Однако это не так. Калий, например, может иметь степень окисления +1 и +2 в различных соединениях. Некоторые исследователи подтверждают возможность существования и отрицательных степеней окисления для щелочных металлов, но эти исследования пока остаются спорными и требуют дальнейшего изучения.
Таким образом, миф о постоянной степени окисления щелочных металлов не соответствует действительности. Вариативность степени окисления в соединениях щелочных металлов открывает новые горизонты для исследований и позволяет узнать больше о свойствах их соединений. Будущие работы в этой области могут пролить свет на многочисленные загадки, связанные с щелочными металлами и их степенями окисления.
Основные свойства щелочных металлов

Щелочные металлы – это первая группа элементов периодической системы химических элементов. Они включают литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают рядом характерных свойств, которые определяют их важное место в химии и технологии.
Высокая активность и реактивность. Щелочные металлы являются самыми активными металлами в периодической системе. Они реагируют с водой, окислителями и многими другими веществами, образуя газы и соли. Например, натрий и вода реагируют, выделяя водород и образуя гидроксид натрия. Такая высокая реактивность является результатом низкой энергии ионизации и большой радиуса атома щелочных металлов.
Низкая плотность. Щелочные металлы имеют низкую плотность, что делает их легкими и легкообрабатываемыми материалами. Например, литий – самый легкий металл в периодической системе. Это свойство позволяет использовать щелочные металлы в различных областях, включая авиацию и электронику.
Хорошая теплопроводность. Щелочные металлы обладают высокой теплопроводностью, что делает их полезными в технологии. Они могут быть использованы в качестве материалов для теплопроводных элементов и теплоотводов. Кроме того, щелочные металлы обладают высокой электропроводностью, что делает их полезными в электронике.
Образование оксидов. Щелочные металлы образуют оксиды при реакции с кислородом. Например, калий может образовывать оксид калия при взаимодействии с воздухом. Эти оксиды имеют различные свойства, включая щелочную реакцию, и могут быть использованы в различных областях промышленности и науки.
Эти основные свойства щелочных металлов делают их полезными во многих областях, включая химическую промышленность, электронику, энергетику и медицину.
Теория постоянной степени окисления

Теория постоянной степени окисления является основным принципом, используемым для определения окислительно-восстановительных свойств различных химических соединений. Согласно этой теории, атомы в химических соединениях могут иметь постоянную степень окисления независимо от связей, которые они образуют. Это означает, что степень окисления атома не меняется ни в одном из его соединений.
Степень окисления атома определяется числовым значением, которое отражает электрохимическую активность данного атома. Положительное значение степени окисления указывает на окислительное состояние атома, а отрицательное значение - на восстановительное состояние.
Теория постоянной степени окисления основана на принципе сохранения массы и электричества. Согласно этому принципу, сумма степеней окисления всех атомов в химическом соединении должна быть равной нулю. Это связано с тем, что ионы различных элементов могут образовывать связи, чтобы достичь электронной стабильности, и эти связи должны быть электрически нейтральными.
Теория постоянной степени окисления широко применяется в химии для определения химических формул, уравнений реакций и определения окислительного или восстановительного свойства веществ. Она позволяет лучше понять процессы окисления и восстановления и предсказать химическую активность веществ в различных условиях.
Распространенные заблуждения о степени окисления щелочных металлов
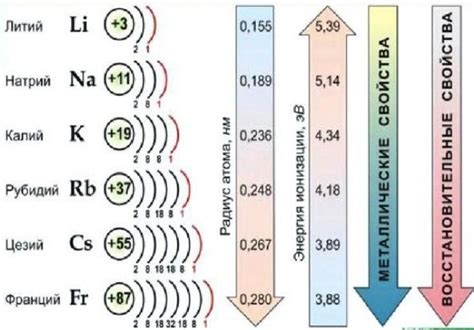
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают уникальными свойствами и широко используются в различных сферах науки и промышленности. Однако вокруг их степени окисления существует несколько распространенных заблуждений.
1. Щелочные металлы имеют постоянную степень окисления.
На самом деле, степень окисления щелочных металлов может варьироваться в зависимости от конкретных условий и реакций. Например, литий может иметь степени окисления +1 или -1, в зависимости от соединения, с которым он взаимодействует. Натрий, калий и другие щелочные металлы также могут иметь различные степени окисления в разных соединениях.
2. Степень окисления щелочных металлов всегда положительная.
Хотя большинство соединений щелочных металлов имеют положительную степень окисления, они также могут образовывать отрицательные и нулевые степени окисления. Например, литий может образовывать соединения, в которых его степень окисления равна -1.
3. Все щелочные металлы имеют одинаковую степень окисления.
Несмотря на то, что щелочные металлы находятся в одной группе периодической таблицы, они имеют разные электронные конфигурации и, следовательно, различную способность образовывать разные степени окисления. Например, литий имеет более высокую способность образовывать соединения с отрицательной степенью окисления, чем другие щелочные металлы.
Вывод.
Степень окисления щелочных металлов не является постоянной и может меняться в зависимости от контекста. Это важно учитывать при изучении свойств и реакций данных элементов, чтобы получить более полное представление о их химических особенностях и возможностях в различных областях науки и технологий.
Почему щелочные металлы имеют разные степени окисления

Щелочные металлы включают в себя элементы первой группы периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы хорошо известны своей высокой химической активностью, которая обусловлена их электронной конфигурацией.
Особенностью щелочных металлов является то, что они имеют всего один валентный электрон в своей внешней электронной оболочке. Этот электрон очень слабо связан с ядром и легко участвует в химических реакциях, образуя стабильные положительные ионы. Окисление щелочных металлов происходит за счет потери этого валентного электрона.
Однако степень окисления щелочных металлов может быть различной и зависит от конкретных условий и химических соединений, в которых они находятся. Например, в соединениях с кислородом (оксидах) щелочные металлы обычно имеют степень окисления +1, так как они потеряли только один электрон. Однако в некоторых случаях, таких как пероксиды, где металл связан с двумя кислородными атомами, степень окисления может достигать +2.
Кроме того, щелочные металлы могут образовывать сплавы с другими металлами, где их степень окисления также может быть изменена. Например, в сплавах с алюминием и железом натрий может иметь степень окисления +3. Таким образом, степень окисления щелочных металлов не является постоянной, а зависит от конкретных химических условий.
Экспериментальные данные о степени окисления щелочных металлов
Степень окисления щелочных металлов в химических соединениях определяет активность их химических свойств. Величина степени окисления показывает, сколько электронов щелочный металл отдал или принял в ходе реакции.
Экспериментальные данные позволяют установить, что щелочные металлы обладают наибольшей степенью окисления +1. Это означает, что они отдают один электрон при образовании химических связей. Однако, в ряде особых случаев, щелочные металлы могут проявлять и более высокую степень окисления.
Например, щелочные металлы в некоторых сложных соединениях, таких как персульфаты или перманганаты, могут иметь степень окисления +5. В таких случаях они отдают все пять своих электронов, что дает им возможность образовывать более сложные связи и проявлять более высокую активность.
Более подробные данные о степени окисления щелочных металлов представлены в таблице ниже:
| Щелочный металл | Степень окисления |
|---|---|
| Литий | +1 |
| Натрий | +1 |
| Калий | +1 |
| Рубидий | +1 |
| Цезий | +1 |
Эти экспериментальные данные подтверждают, что степень окисления щелочных металлов в обычных условиях составляет +1, хотя в некоторых особых случаях щелочные металлы могут иметь и более высокую степень окисления.
Возможные применения знаний о степени окисления щелочных металлов

Знание степени окисления щелочных металлов имеет широкие практические применения, которые охватывают различные области научных и технических исследований. Одним из основных применений является электрохимическая промышленность, где щелочные металлы используются в процессах электролиза и производстве различных электрохимических устройств.
Знание степени окисления щелочных металлов также необходимо в области синтеза и каталитических процессов. Ценность этого знания проявляется в разработке новых катализаторов и оптимизации химических реакций, основанных на применении щелочных металлов. Правильное определение степени окисления помогает улучшить эффективность и выборочность этих процессов.
Другим важным применением знания о степени окисления щелочных металлов является область солнечных батарей и энергетических хранителей. Использование щелочных металлов в этих технологиях связано с их способностью образовывать ионы, которые легко перемещаются внутри электродов, обеспечивая высокую эффективность энергетического преобразования.
Кроме того, знание степени окисления щелочных металлов позволяет разработать новые материалы с определенными физико-химическими свойствами. Например, полупроводники на основе щелочных металлов могут иметь различные структуры и фазовые состояния в зависимости от степени окисления, что открывает новые возможности в области электроники и нанотехнологий.
Вопрос-ответ

Почему щелочные металлы имеют постоянную степень окисления?
Щелочные металлы имеют постоянную степень окисления из-за своей электронной конфигурации. У них только один электрон в валентной оболочке, поэтому они готовы передать его другим элементам и образовать ион с положительным зарядом, сохраняя постоянную степень окисления.
Существуют ли исключения из этого правила?
Да, существуют исключения. Например, в некоторых соединениях щелочные металлы могут иметь другую степень окисления, если взаимодействуют с элементами, которые имеют большую афинность к электронам. Однако, в большинстве случаев щелочные металлы сохраняют постоянную степень окисления.
Влияет ли постоянная степень окисления на свойства щелочных металлов?
Да, постоянная степень окисления имеет влияние на свойства щелочных металлов. Она определяет их химическую активность, способность образовывать ионы и воздействие на окружающую среду.
Почему именно щелочные металлы имеют постоянную степень окисления, а не другие элементы?
Щелочные металлы имеют постоянную степень окисления из-за своей электронной конфигурации. У них только один электрон в валентной оболочке, поэтому они готовы передать его другим элементам и образовать ион с положительным зарядом, сохраняя постоянную степень окисления. Другие элементы имеют различное число электронов в валентной оболочке и, соответственно, могут иметь разные степени окисления.
Какую практическую пользу можно извлечь из знания о постоянной степени окисления щелочных металлов?
Знание о постоянной степени окисления щелочных металлов может быть полезно в различных химических реакциях и процессах. Оно позволяет предсказать и объяснить результаты реакций, контролировать и оптимизировать процессы синтеза соединений и применять щелочные металлы в различных технологических процессах.
