Амфотерные металлы - это металлы, которые проявляют свойства и характерные для кислот и оснований. Одним из наиболее известных амфотерных металлов является алюминий.
Алюминий - это элемент периодической таблицы с атомным номером 13. Он обладает серебристо-белым металлическим блеском и является третьим по распространенности металлом в земной коре. Алюминий является очень легким металлом, его плотность составляет около трети плотности стали.
Особенностью алюминия является его амфотерность. Он может реагировать как с кислотами, так и с основаниями. В реакции с кислотами алюминий образует соли, например, сульфат алюминия (Al2(SO4)3). При этом он выделяет молекулярный водород и образует ион алюминия, Al3+. Амфотерное поведение алюминия проявляется также при его взаимодействии с щелочами, когда образуются алюминаты.
Кроме того, алюминий обладает свойством окисляться на воздухе, образуя пленку оксида Al2O3 (алюминия). Эта оксидная пленка является нерастворимой в воде, что обеспечивает алюминию высокую устойчивость к коррозии. Эта пленка защищает металл от дальнейшего окисления и придает алюминию его характерную устойчивость и стойкость.
Амфотерные металлы: определение и значение
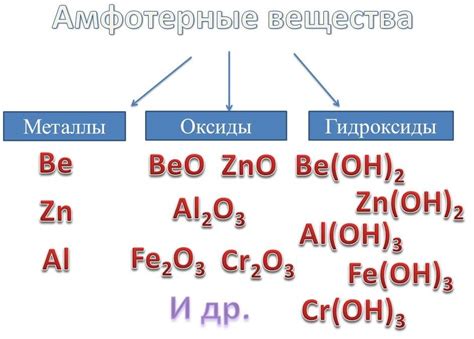
Амфотерные металлы - это тип металлов, которые могут реагировать как с кислотами, так и с основаниями. Термин "амфотерный" происходит от греческого слова "амфотерос", что означает "оба направления".
Амфотерные металлы имеют особое значение в химии, так как они обладают широким спектром реакций и могут проявлять различные свойства в зависимости от условий.
Одним из наиболее известных примеров амфотерных металлов является алюминий. Алюминий может реагировать с кислотами, образуя соли, а также с основаниями, образуя гидроксиды. Таким образом, алюминий может проявлять как кислотные, так и основные свойства.
Амфотерные металлы играют важную роль в различных процессах и промышленных приложениях. Например, алюминиевые сплавы используются в авиационной и автомобильной промышленности благодаря своей прочности и легкости. Кроме того, алюминий широко применяется в производстве упаковки и оборудования, а также в производстве конструкционных материалов и средств передвижения.
В заключение, амфотерные металлы, такие как алюминий, имеют огромное значение в химии и промышленности. Они обладают способностью реагировать с кислотами и основаниями, их свойства могут быть изменены в зависимости от условий. Амфотерные металлы играют важную роль в различных сферах, начиная от авиационной промышленности и заканчивая производством упаковки и конструкционных материалов.
Амфотерные металлы: примеры и свойства
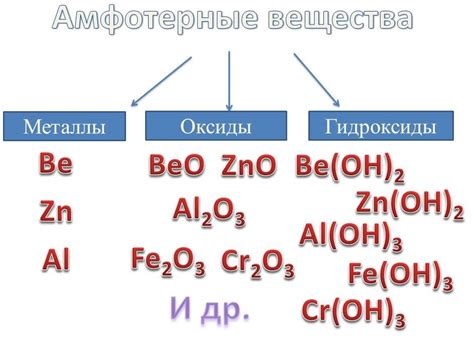
Амфотерные металлы — это металлы, которые могут образовывать как катионы, так и анионы в различных кислотных и основных реакциях. Они обладают особой химической активностью и могут проявлять амфотерные свойства в различных условиях.
Один из примеров амфотерных металлов — алюминий. Этот металл проявляет амфотерные свойства, так как он может образовывать как катион Al3+, так и анион Al(OH)4-. В кислотных условиях алюминий является электронно-акцепторным, а в щелочных условиях он действует как электронно-донорный. Алюминий тесно связан с водой и образует гидроксиды, которые обладают амфотерными свойствами.
Амфотерность металлов связана с их электронной структурой и способностью переходить в различные окислительные состояния. Это позволяет им проявлять как кислотные, так и основные свойства. Такие металлы, как алюминий, могут реагировать с различными кислотами и щелочами, в зависимости от условий окружающей среды.
Важно отметить, что не все металлы обладают амфотерными свойствами. Такие металлы, как натрий, калий и железо, имеют устойчивую окислительную форму и не могут проявлять амфотерность. Однако амфотерные металлы играют важную роль в различных химических реакциях и имеют широкое применение в промышленности и научных исследованиях.
Химические свойства амфотерных металлов
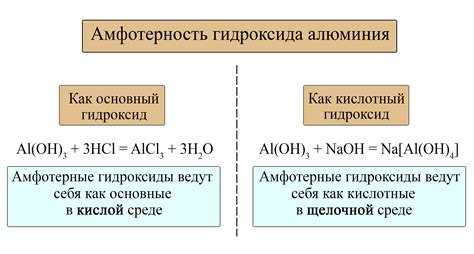
Амфотерные металлы — это металлы, которые могут проявлять и кислотные, и основные свойства в зависимости от условий реакции.
Одним из хороших примеров амфотерного металла является алюминий. Алюминий обладает способностью реагировать как с кислотами, так и с основаниями.
AлX3 + 3Н2O = Х2О + 3НХ(Х=Cl, Br, I)
2AлX3 + 6Н2O = Х2(ОН)4 + 6НХ(Х=Cl, Br, I)
AлX3 + 3CO3Н2С + 3H2О = CO3Ал2(ОН)3 + 3НХ(Х=Cl, Br, I)
Амфотерные свойства алюминия обусловлены его специфической структурой и наличием оксида алюминия (Al2O3) на поверхности металла. Ионы алюминия (Al3+) способны вступать в реакцию как с протонами кислот, так и с гидроксидными ионами оснований.
Как кислота, алюминий может реагировать с щелочами, образуя соли алюминиевых гидроксидов. Как основание, алюминий может реагировать с кислотами, образуя соли алюминиевых солей.
Однако, амфотерные металлы обычно не проявляют одновременно кислотные и основные свойства в одной и той же реакции, так как в реакциях они должны присутствовать в диссоциированном виде — как ион.
Реакция амфотерных металлов с кислотами

Амфотерные металлы - это группа элементов, которые могут реагировать как с кислотами, так и с основаниями. Алюминий является одним из наиболее известных амфотерных металлов. Он образует различные соединения с разными типами кислот.
Алюминий реагирует с сильными кислотами, такими как соляная кислота (HCl), образуя соль алюминия и высвобождая водород. Реакция может быть представлена следующим уравнением:
2 Al + 6 HCl → 2 AlCl3 + 3 H2
Также алюминий может реагировать с кислотами средней силы, например с уксусной кислотой (CH3COOH). В результате образуется соль алюминия и высвобождается углекислый газ:
2 Al + 3 CH3COOH → 2 Al(CH3COO)3 + 3 CO2 + 3 H2O
В добавление к этим реакциям, алюминий способен реагировать с некоторыми слабыми кислотами, например с кислородным газом (O2). В результате образуется окисленное соединение, а вода высвобождается:
4 Al + 3 O2 → 2 Al2O3
Таким образом, реакция амфотерных металлов, включая алюминий, с кислотами проявляется в образовании солей и выделении газов. Реакция может быть сильной (с сильными кислотами) или слабой (с слабыми кислотами), в зависимости от типа кислоты.
Реакция амфотерных металлов с щелочами

Амфотерные металлы обладают способностью проявлять химическую активность как с кислотами, так и с щелочами. Один из таких металлов – алюминий.
При взаимодействии алюминия с щелочами происходит образование солей – алюминатов. Например, при реакции алюминия с гидроксидом натрия (щелочью) образуются алюминат натрия и молекула воды:
2Al + 2NaOH + 6H₂O → 2Na[Al(OH)₄] + 3H₂
Получаемая соль имеет кристаллическую структуру и хорошо растворяется в воде. Алюминаты обладают высокой щелочностью и могут использоваться в различных процессах, включая производство стекла и керамики.
Степень растворимости алюмината зависит от условий реакции и концентрации реагентов. В щелочной среде амфотерные металлы, такие как алюминий, проявляют свои особенности и имеют возможность формировать стабильные соединения с щелочами.
Алюминий

Алюминий - это химический элемент в таблице периодов с атомным номером 13 и символом Al. Он является третьим по распространенности элементом в земной коре и самым распространенным металлом во Вселенной.
Алюминий является амфотерным металлом, что означает, что он может реагировать как с кислотами, так и с щелочами. Он образует оксид Al2O3, который проявляет свойства как оснований, так и кислоты. Это позволяет алюминию проявлять свою реакционную способность в различных средах.
Одним из самых известных свойств алюминия является его высокая коррозионная стойкость. Благодаря образованию защитной пленки оксида на поверхности металла, алюминий не подвержен ржавчине и коррозии в обычных условиях. Однако, в кислотных или щелочных средах алюминий может реагировать и разрушаться.
Алюминий также обладает высокой проводимостью электричества и тепла, что делает его полезным материалом для проводов и конструкций. Он также легкий, прочный и устойчив к низким температурам, что делает его идеальным материалом для использования в авиации, строительстве и многих других отраслях промышленности.
В целом, алюминий - это универсальный металл с широким спектром свойств и применений. Его уникальные химические свойства и физические характеристики делают его важным материалом в современном обществе.
Химические свойства алюминия

Алюминий (Al) - это легкий и прочный металл с атомным номером 13 и атомной массой около 27. Символ Al происходит от латинского названия алюминия, а его название происходит от латинского слова alumen, что означает альюминиевая соль.
Алюминий обладает высокой коррозионной стойкостью благодаря тонкому слою естественной оксидной пленки на его поверхности. Этот слой предотвращает дальнейшую реакцию с окружающей средой и защищает металл от коррозии.
Алюминий является амфотерным металлом, что означает, что он может реагировать как с кислотами, так и с щелочами. Он проявляет нейтрализующие свойства при контакте с кислотами, образуя соли и выделяяся из раствора в виде осадка. С щелочами алюминий реагирует, образуя алюминиевые гидроксиды.
Алюминий формирует сплавы с другими металлами, такими как медь и магний, что значительно улучшает его механические свойства. Эти сплавы широко используются в промышленности, например, в авиастроении, строительстве и производстве упаковочных материалов.
Алюминий также является важным компонентом многих минералов, таких как бокситы и фельдспары. Он является третьим самым распространенным химическим элементом на Земле после кислорода и кремния.
Вопрос-ответ

Что такое амфотерные металлы?
Амфотерные металлы - это металлы, которые обладают свойствами образовывать как кислотные, так и основные соединения в реакциях с различными веществами.
Какие еще металлы являются амфотерными, кроме алюминия?
Кроме алюминия, также амфотерными металлами являются некоторые другие элементы, включая цинк (Zn), олово (Sn) и свинец (Pb).
Как проявляются химические свойства алюминия?
Алюминий проявляет свои амфотерные свойства в контакте с кислотами и щелочами. С кислотами он реагирует, выделяя гидроген и образуя соли алюминия. С щелочами алюминий также реагирует, образуя алюминаты металлов.
В каких промышленных отраслях используется алюминий?
Алюминий широко используется в промышленности, прежде всего в авиационной, автомобильной и строительной отраслях. Он также используется для производства электродов, проводов, упаковочных материалов и т. д.
Какие вещества могут реагировать с алюминием?
Алюминий может реагировать с многими веществами, включая кислоты (например, серной и соляной), оксиды (например, оксид углерода), галогены (например, хлор) и щелочи (например, натрий и калий).
