Электролиз – это процесс, который используется для получения многих металлов из их расплавов солей. Благодаря электролизу можно получить такие металлы, как алюминий, цинк, медь, свинец, никель и другие. Этот метод основан на использовании электрического тока, который приводит к химическим изменениям в растворе соли металла. В результате этих изменений происходит осаждение металла на электроде, или катоде, и разделение компонентов соли на аноде.
Выбор металлов, которые можно получить с помощью электролиза, зависит от их химической активности. Электролиз применяется для металлов, которые имеют высокую степень химической активности и не могут быть получены другими способами. Например, алюминий является одним из таких металлов. Он довольно активен химически и не встречается в природе в чистом виде. Поэтому для его получения используется процесс электролиза.
Для процесса электролиза требуются специальные условия. Металл должен находиться в расплаве с его соляной соли, такой как алюминий в расплаве алюминия. В процессе электролиза анодом может быть использован металл, который окисляется, а катодом – материал, на котором осаждается металл. Применение электролиза для получения металлов из их солей дает возможность производить их в больших количествах и с высокой степенью чистоты.
Процесс электролиза: получение металлов из расплавов солей

Процесс электролиза является важным методом получения металлов из их расплавов солей. В ходе этого процесса электрический ток используется для разложения расплава солей на элементы – металлы и неметаллы. Электролиз осуществляется в электролитической ячейке, которая представляет собой систему с двумя электродами – анодом и катодом, и электролитом, являющимся ионной средой.
Во время электролиза катод притягивает положительно заряженные ионы, тогда как анод притягивает отрицательно заряженные ионы. Какие именно металлы могут быть получены из расплавов солей зависит от их степени окисления. Например, к металлам, которые имеют низкое степень окисления, относятся натрий, калий, магний, кальций и алюминий.
Процесс электролиза имеет широкое применение в производстве металлов. Например, натрий получается из расплава соли NaCl, калий – из соли КCl, алюминий – из соли Al2O3. Получаемые металлы обладают важными свойствами, которые позволяют им использоваться в различных областях, таких как химическая промышленность, электротехника, строительство и другие.
Механизм электролиза и его применение
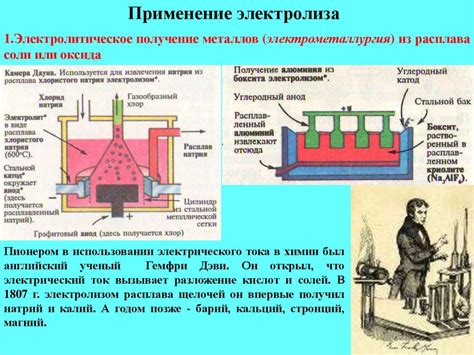
Электролиз - процесс разложения вещества с использованием электрического тока. Он основан на применении принципа электродиффузии и позволяет получать различные металлы из их расплавов солей. Механизм электролиза основан на направленном движении ионов под воздействием электрического поля.
В процессе электролиза используются специальные устройства, называемые электролизерами. Они состоят из контейнера с расплавом соли, в котором помещены два электрода - анод и катод. Анод – позитивно заряженный электрод, к которому подключается положительный полюс источника электрического тока. Катод – отрицательно заряженный электрод, к которому подключается отрицательный полюс источника электрического тока.
Применение электролиза широко распространено в металлургии для получения различных металлов. Например, алюминий получают электролизом расплава алюминиевой оксидной руды в криолите. Железо и медь получают из их расплавов солей с помощью электролиза. Также электролиз применяется в гальванике для нанесения металлических покрытий на поверхности деталей.
Образование катионов и анионов в растворе

Процесс электролиза основан на образовании катионов и анионов в растворе. Катионы - это положительно заряженные ионы, а анионы - отрицательно заряженные ионы.
При электролизе растворов солей происходит разложение соли на ионы. Положительный ион металла, который будет получаться в результате электролиза, называется катионом. Например, при электролизе раствора хлорида натрия (NaCl) образуются катионы натрия (Na+).
Отрицательный ион, который образуется в результате электролиза, называется анионом. Анионы образуются от отрицательно заряженных ионов, которые присутствуют в растворе. Вернемся к примеру с раствором хлорида натрия: в результате электролиза образуются анионы хлора (Cl-).
Выбор металла, который будет получаться в результате электролиза, зависит от его положения в ряду напряжений металлов. Если металл находится выше других металлов в ряду, то он будет получаться из раствора соли. Например, натрий, находящийся выше магния в ряду напряжений, получается из раствора хлорида натрия.
Образование катионов и анионов в растворе является важной составляющей процесса электролиза. Оно позволяет получать различные металлы из расплавов солей и определяется положением металлов в ряду напряжений.
Выбор металлов для электролиза

Процесс электролиза является эффективным способом получения различных металлов из расплавов солей. Выбор металлов для электролиза зависит от их химических свойств и потребностей промышленности.
Важным критерием при выборе металлов для электролиза является их поглощение электронов. Металлы с положительным электродным потенциалом, такими как натрий, калий и магний, могут быть получены из расплавов соответствующих солей.
Другой важный фактор - стоимость и доступность металла. Например, цинк и алюминий получают из их соответствующих солей, так как они являются относительно дешевыми и широко распространенными элементами. Электролиз известкового молока дает кальций и гидроксид железа.
При выборе металлов для электролиза также учитываются их физические свойства. Например, некоторые металлы, такие как ртуть или кадмий, имеют низкую температуру плавления и подходят для процесса электролиза при комнатной температуре.
Таким образом, выбор металлов для электролиза определяется их электродным потенциалом, стоимостью, доступностью и физическими свойствами.
Физические свойства и применение полученных металлов

Металлы, получаемые из расплавов солей посредством процесса электролиза, обладают различными физическими свойствами и имеют широкий спектр применений в различных областях промышленности.
Один из таких металлов - алюминий. Он обладает легкостью и низкой плотностью, что делает его идеальным для применения в легкомашиностроении и авиационной промышленности. Алюминиевые сплавы также используются в строительстве для создания прочных и легких конструкций.
Еще одним металлом, получаемым из расплавов солей, является медь. Он обладает высокой электропроводностью и теплопроводностью, что делает его идеальным материалом для использования в электротехнике и строительстве. Медные провода широко используются для передачи электричества, а медные трубы - для теплоотвода и водоснабжения.
Отдельно стоит упомянуть такой металл, как цинк. Он обладает высокой коррозионной стойкостью и используется в качестве защитного покрытия для стали. Цинк также используется в производстве литейного сплава для создания деталей со сложной формой и точности.
Некоторые металлы, полученные из расплавов солей, такие как никель, кобальт и титан, имеют специфические свойства, которые позволяют им использоваться в производстве специализированных изделий, таких как легкие и прочные сплавы для авиационной промышленности, магниты для электронных устройств, а также сложные химические соединения для производства лекарств и катализаторов.
Роль электролиза в металлургии и химической промышленности
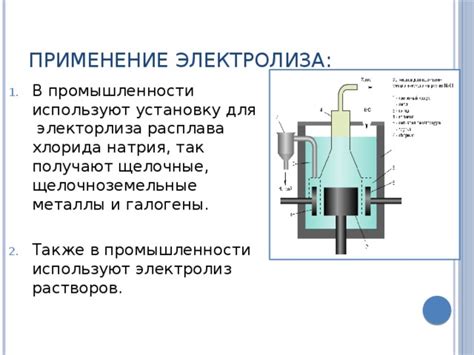
Электролиз является важным процессом в металлургии и химической промышленности, позволяющим получать металлы из их расплавов солей. Он основан на принципе разложения вещества под воздействием электрического тока, известного как электролитическое разложение.
В металлургии электролиз применяется для получения металлов, таких как алюминий, медь, свинец и цинк. Например, процесс электролиза используется в производстве алюминия из бокситовой руды. Расплав бокситовой руды служит электролитом, а катодами являются графитовые стержни. Под воздействием электрического тока происходит разложение боксита на алюминий и кислород, который выделяется в виде газа. Полученный алюминий жидкий и далее используется для изготовления различных металлических изделий.
В химической промышленности электролиз применяется для получения чистых металлов и различных химических соединений. Например, электролиз используется при производстве хлора и натрия из поваренной соли (хлорида натрия). Расплав хлорида натрия служит электролитом, а в результате электролиза на катоде образуется натрий, а на аноде хлор. Полученные продукты дальше используются для различных целей, например, натрий применяется в производстве щелочи, а хлор — в производстве пластмасс и хлорорганических соединений.
Таким образом, электролиз играет важную роль в металлургии и химической промышленности, позволяя получать различные металлы из их расплавов солей. Процесс электролиза обладает большой значимостью, так как позволяет получать чистые металлы и химические продукты, которые находят применение в различных отраслях промышленности и повседневной жизни.
Возможные проблемы и методы их решения
В процессе электролиза возможны различные проблемы, которые могут возникнуть из-за неправильных условий, ошибок оператора или нарушений в процессе. Существует несколько методов решения этих проблем:
1. Перекисание электролита: Возможно повышение концентрации пероксидов в электролите, что приводит к образованию пузырьков на аноде. Чтобы решить эту проблему, необходимо регулярно проверять и поддерживать оптимальную концентрацию электролита, а также контролировать равномерность течения электрического тока.
2. Намокание анода: В процессе электролиза возможно намокание анода, что приводит к его коррозии и загрязнению электролита. Для решения этой проблемы рекомендуется использовать аноды из нержавеющей стали или других устойчивых к коррозии материалов, а также регулярно проверять состояние и чистоту анода.
3. Образование осадков: В некоторых случаях при электролизе могут образовываться осадки на поверхности катода или анода. Это может происходить из-за неправильных условий процесса или наличия примесей в электролите. Для предотвращения образования осадков необходимо проводить регулярную очистку и обслуживание электролита, а также контролировать его состав и концентрацию.
4. Расплавление анода: В случае высокой температуры или неправильных условий процесса может происходить расплавление анода. Это может привести к повреждению оборудования и нарушению работы электролиза. Для решения этой проблемы необходимо правильно подобрать материал анода, контролировать температуру и обеспечивать правильные условия процесса.
В целом, для успешной реализации процесса электролиза и получения металлов из расплавов солей необходимо контролировать и поддерживать оптимальные условия процесса, регулярно проводить проверку и обслуживание оборудования, а также решать возникающие проблемы оперативно и комплексно. Это позволит обеспечить эффективность и надежность процесса электролиза.
Учет экономических факторов при выборе металлов для электролиза

При выборе металлов для электролиза важным фактором является их экономическая целесообразность. Ведь затраты на процесс электролиза могут быть достаточно высокими и зависят от различных факторов.
Один из основных экономических факторов - стоимость металла. Важно выбрать металл, производство которого будет эффективно с точки зрения затрат. Некоторые металлы могут быть достаточно дорогими, что может увеличить общие затраты на электролиз.
Также важным фактором является потребление энергии при электролизе. Процесс электролиза требует значительного количества энергии, и чем больше энергии потребуется для получения металла, тем выше будут затраты на его производство. Поэтому выбор металла должен учитывать источник энергии, его стоимость и возможность использования возобновляемых источников.
Еще одним важным экономическим фактором является рыночная ситуация. Спрос на определенный металл, его цена и возможность его реализации на рынке также влияют на выбор металла для электролиза. Если на рынке большой спрос на конкретный металл, то его производство может быть более выгодным.
Таким образом, при выборе металлов для электролиза необходимо учитывать экономические факторы, такие как стоимость металла, энергозатраты и рыночная ситуация. Только тщательный анализ этих факторов позволит выбрать наиболее эффективный и экономически выгодный процесс электролиза для получения нужного металла.
Влияние условий электролиза на качество получаемых металлов

Температура расплава: Одним из важных условий электролиза является правильный выбор температуры расплава соли. Температура должна быть достаточно высокой, чтобы обеспечить достаточное электропроводность расплава и эффективное разложение соли на ионы, но не такой высокой, чтобы вызывать нежелательные побочные реакции. Слишком высокая температура может привести к окислению получаемого металла, а слишком низкая - к его примеси.
Плотность тока: Плотность тока является еще одним ключевым фактором, влияющим на качество получаемых металлов. Высокая плотность тока может привести к образованию большого количества газовых пузырей на электроде, что может вызвать покрытие металла взвешенными частицами и привести к неравномерной отложению металла на электроде. Низкая плотность тока, с другой стороны, может привести к медленной реакции и неэффективному получению металла.
Состав соли: Качество получаемого металла также зависит от состава соли, из которой он получается. Разные соли содержат разные металлы, которые могут иметь разную чистоту и свойства. Некоторые соли могут содержать примеси, которые могут оказывать негативное влияние на получаемый металл. Поэтому важно выбирать соль с нужным составом для получения высококачественного металла.
Время электролиза: Время электролиза является также важным фактором, определяющим качество получаемого металла. Слишком короткое время может привести к недостаточной отделке металла и его низкой чистоте, а слишком долгий процесс может привести к излишней потере металла, окислению или другим нежелательным реакциям. Правильное время электролиза должно быть оптимизировано для каждого конкретного металла и условий процесса.
Вопрос-ответ

Какие металлы можно получить из расплавов солей?
Из расплавов солей можно получить различные металлы, такие как алюминий, медь, свинец, никель, цинк и др.
Как происходит процесс электролиза?
Процесс электролиза осуществляется путем применения постоянного электрического тока к расплавам солей, что приводит к разложению электролита на ионы и осаждению металлов на электродах.
Почему металлы получают из расплавов солей?
Металлы получают из расплавов солей, потому что многие металлы природным образом существуют в виде руд или растворов в солевых составах, и электролиз позволяет разделить их на чистые металлические элементы.
Какие факторы влияют на эффективность процесса электролиза?
Эффективность процесса электролиза зависит от таких факторов, как температура расплава, концентрация электролита, величина электрического тока, время проведения электролиза и др.
Какие промышленные процессы используют электролиз для получения металлов?
Электролиз используется в различных промышленных процессах для получения металлов, например, в производстве алюминия, меди, цинка, свинца и других важных промышленных металлов.
