Электрохимический потенциал (ЭЧП) металла является важным параметром, который определяет его способность принимать участие в электрохимических реакциях. Он представляет собой меру силы с которой атом металла кислородом или другим веществом окисляется или восстанавливается. ЭЧП определяется разницей в потенциале между металлом и стандартным водородным электродом.
Знание электрохимических потенциалов металлов позволяет предсказывать направление реакций в электрохимии. Металлы с более низким электрохимическим потенциалом будут склонны к окислению, тогда как металлы с более высоким электрохимическим потенциалом будут склонны к восстановлению. Это явление можно использовать для создания гальванических элементов и электролиза в различных промышленных процессах.
Список электрохимических потенциалов металлов называется рядом напряжений или рядом электрохимических потенциалов. Существует возможность сравнивать потенциалы разных металлов, чтобы предсказать их активности в реакциях. Потенциалы металлов также могут быть использованы для расчета электродных потенциалов реакций и предсказания возможных продуктов.
Значение электрохимических потенциалов металлов
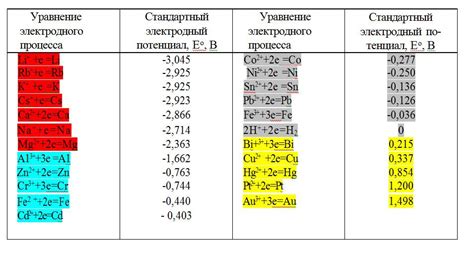
Электрохимический потенциал металлов определяет их способность участвовать в электрохимических реакциях. Он связан с тенденцией металла отдавать или принимать электроны в реакциях окисления или восстановления. Значение электрохимического потенциала измеряется в вольтах и указывает на то, насколько металл «желает» перейти в окисленное или восстановленное состояние.
Электрохимический ряд – это упорядоченный список металлов по значениям их электрохимических потенциалов. В этом ряду металлы располагаются в порядке увеличения их потенциала. Так, металлы с наибольшими положительными значениями потенциала (например, литий и калий) имеют большую способность восстанавливаться, а металлы с наименьшими отрицательными значениями (например, медь и серебро) склонны к окислению.
Значение электрохимического потенциала металлов определяет их активность в реакциях электрохимии и может использоваться для предсказания направления электрохимических реакций. Металлы с более высоким потенциалом оказывают большее влияние на процессы окисления, в то время как металлы с более низким потенциалом склонны к восстановлению.
Значение электрохимических потенциалов металлов также может быть использовано для определения их избирательности, то есть способности происходить только с определенными веществами. Металлы с высокими потенциалами могут реагировать только с веществами, обладающими более низкими потенциалами, в то время как металлы с низкими потенциалами могут взаимодействовать с веществами, обладающими как более высокими, так и более низкими потенциалами.
Влияние электрохимических потенциалов на реакции
Электрохимические потенциалы металлов играют ключевую роль в электрохимических реакциях. Потенциалы металлов определяют их способность быть окислителями или восстановителями, а также направление электронного течения в электрохимической ячейке.
Каждый металл имеет свой уникальный электрохимический потенциал, который характеризует его склонность отдавать или принимать электроны. Металлы с более высокими электрохимическими потенциалами являются сильными окислителями, так как они легче отдают электроны, а металлы с более низкими электрохимическими потенциалами служат сильными восстановителями, так как они легче принимают электроны.
В электрохимических реакциях происходит переход электронов от вещества с более низким электрохимическим потенциалом к веществу с более высоким потенциалом. Этот процесс может быть использован для приведения в действие электрической энергии или для преобразования химических веществ. Как правило, при этом процессе металл с более низким электрохимическим потенциалом окисляется, а металл с более высоким потенциалом восстанавливается.
Таким образом, знание электрохимических потенциалов металлов позволяет предсказать направление электрохимических реакций и составить ряд активности металлов. Это является важным инструментом в электрохимии и позволяет контролировать и управлять химическими процессами с помощью электрической энергии.
Вопрос-ответ

Зачем нужны электрохимические потенциалы металлов?
Электрохимические потенциалы металлов играют ключевую роль в электрохимических реакциях. Они определяют направление потока электронов во время окислительно-восстановительных реакций. Более точно, электрохимический потенциал металла показывает его склонность отдавать электроны. Высокий электрохимический потенциал указывает, что металл имеет большую склонность отдавать электроны, в то время как низкий потенциал указывает на обратное поведение.
Как электрохимические потенциалы металлов влияют на электрохимические реакции?
Электрохимические потенциалы металлов влияют на электрохимические реакции, определяя направление потока электронов. Когда два различных металла погружаются в электролит и контактируют друг с другом, реакция окисления происходит на поверхности металла с более низким электрохимическим потенциалом, а реакция восстановления происходит на поверхности металла с более высоким потенциалом. Таким образом, электрохимические потенциалы металлов определяют, какие металлы окисляются и восстанавливаются в электрохимической системе.
Какие металлы имеют самый высокий электрохимический потенциал?
Самый высокий электрохимический потенциал имеет литий, чье значение составляет около -3.04 В по отношению к стандартному водородному электроду (SHE). Он отличается высокой склонностью отдавать электроны. За литием следуют калий, рубидий, цезий и франций (все они принадлежат к семейству щелочных металлов) с показателями электрохимического потенциала около -2.92 В.
