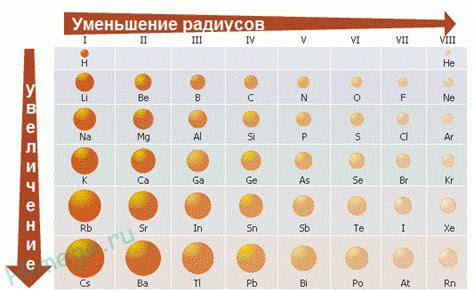
Радиус атома является одним из основных характеристик химического элемента. У каждого элемента в таблице Менделеева есть свой уникальный атомный радиус, который определяется размером иструктурой его электронной оболочки. Существуют различные факторы, влияющие на радиус атома металла, одним из которых является классификация элементов по классам.
Металлы являются одной из трех основных групп элементов в таблице Менделеева. Они характеризуются относительно большими атомными радиусами по сравнению с другими элементами. Однако, радиус атомов металлов может меняться в зависимости от класса элемента в его группе.
В первом классе находятся щелочные металлы, такие как литий и натрий. Атомный радиус этих металлов увеличивается снизу вверх в группе, из-за увеличения числа электронных оболочек. Аналогично, у щелочноземельных металлов второго класса, таких как магний и бериллий, радиусы атомов увеличиваются от верхней к нижней части группы.
В других классах, таких как классы переходных металлов, лантаноидов и актиноидов, существует более сложная зависимость радиуса атомов от класса элемента. В этих классах металлов радиусы атомов могут меняться в зависимости от несколькихфакторов, таких как электронная конфигурация и наличие внутренних оболочек.
Зависимость радиуса атомов металлов от класса элемента
Радиус атома металла является одним из ключевых параметров, определяющих его химические и физические свойства. Зависимость радиуса атомов металлов от класса элемента включает несколько основных трендов и закономерностей.
Периодическая таблица химических элементов подразделяет металлы на несколько классов: алкалиновые металлы, щелочноземельные металлы, переходные металлы, легкие и тяжелые металлы. Каждый класс имеет свои особенности в строении и размерах атомов.
В алкалиновых металлах, таких как литий, натрий, калий, радиус атома увеличивается с увеличением номера периода. Это связано с добавлением нового электронного слоя, что приводит к увеличению эффективного заряда наружных электронов и расширению электронной оболочки.
У щелочноземельных металлов, таких как магний, кальций, стронций, атомный радиус также увеличивается с увеличением номера периода. Однако, по сравнению с алкалиновыми металлами, расширение электронной оболочки является менее значительным из-за большего заряда ядра и наличия слоя inner core electrons.
Переходные металлы характеризуются более сложными зависимостями радиуса атомов от класса элемента. У этих металлов наблюдается незначительное увеличение радиуса в пределах одного периода, но существенное увеличение при переходе на следующий период.
Тяжелые металлы, такие как свинец, ртуть, обладают наименьшими атомными радиусами среди всех классов металлов. Это связано с сильным притяжением ядра к внешним электронам и компактным строением электронной оболочки.
Таким образом, зависимость радиуса атомов металлов от класса элемента демонстрирует различия в строении и свойствах атомных структур, которые влияют на химические и физические свойства металлов.
Металлы 1 класса: радиус атомов
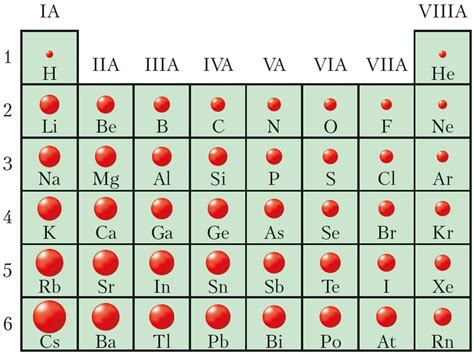
Металлы 1 класса включают в себя литий, натрий, калий, рубидий и цезий. Радиус атома является одним из основных свойств металла, определяющим его химические и физические свойства. Радиус атома обычно измеряется в пикометрах (1 пикометр равен 10^-12 метрам).
Литий (Li) является наименьшим по размеру атомом среди всех металлов первого класса. Его радиус атома составляет около 152 пикометра.
Натрий (Na) имеет радиус атома примерно 186 пикометров. Калий (K) имеет радиус около 227 пикометров, рубидий (Rb) – около 248 пикометров, а цезий (Cs) – около 265 пикометров.
Сравнивая радиусы атомов металлов 1 класса, можно сделать вывод, что с увеличением номера элемента в таблице Менделеева, радиус атома растет. Это особенно заметно при сравнении лития и цезия – самых крайних элементов данного класса.
Металлы 2 класса: радиус атомов
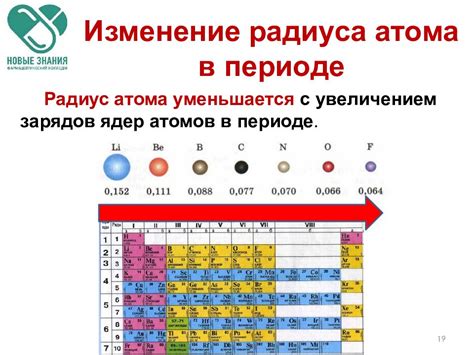
Металлы второго класса, также известные как переходные металлы, обладают особыми химическими свойствами, которые нельзя найти у других элементов периодической системы. Они расположены в середине таблицы Менделеева и включают такие элементы, как железо, медь, никель, цинк и другие.
Радиус атома является важной характеристикой элементов и влияет на их химические свойства и взаимодействие с другими веществами. Для металлов второго класса радиус атомов обычно находится в диапазоне от 100 до 200 пикометров.
Переходные металлы характеризуются наличием внутренней подобности в строении. Это означает, что атомы переходных металлов могут образовывать сложные структуры, такие как кластеры и полимеры. Различные ионы и валентности переходных металлов также влияют на их радиус атомов и химические свойства.
Радиус атомов металлов второго класса может меняться в зависимости от физических условий, таких как температура и давление. Кроме того, радиусы атомов могут варьироваться в пределах одного элемента в разных соединениях или различных кристаллических структурах.
Важно отметить, что радиус атомов металлов второго класса не является постоянной величиной и может быть изменен в результате химических реакций или взаимодействия с другими веществами. Поэтому, исследование радиусов атомов этих металлов играет важную роль в понимании их химического поведения и применений в различных областях науки и техники.
Металлы 3 класса: радиус атомов

Металлы 3 класса включают элементы, расположенные в периодической системе на границе между металлами и полуметаллами. В этом классе находятся такие элементы, как галлий (Ga), индий (In) и таллий (Tl). Они обладают рядом свойств, которые отличают их от элементов других классов.
Радиус атомов металлов 3 класса имеет свои особенности. Он увеличивается по мере перехода от галлия к таллию. Галлий, находящийся в начале класса, имеет меньший радиус атома, чем таллий, который находится в конце класса. Разница в радиусе атомов объясняется эффектом экранования, вызванным внутренними электронными оболочками.
Если галлий имеет радиус атома около 130 пикометров, то радиус атома таллия достигает примерно 170 пикометров. Это значительное увеличение радиуса связано с увеличением числа электронов и уровней заполненных электронами энергетических уровней. Также следует отметить, что радиусы атомов металлов 3 класса превышают радиусы атомов элементов классов 1 и 2, что связано с их положением в периодической системе элементов.
Изучение радиусов атомов металлов 3 класса является важным для понимания их химических и физических свойств. Размер атома влияет на многое: от реакционной способности до возможности образования соединений и материалов с определенными свойствами. Поэтому, знание радиусов атомов металлов 3 класса позволяет лучше понять их реакционную способность и использовать их в различных областях науки и техники.
Металлы 4 класса: радиус атомов
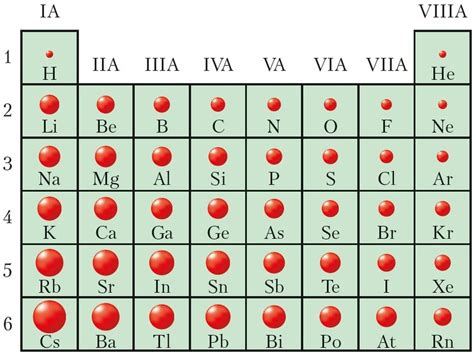
Металлы 4 класса включают в себя элементы IV группы периодической системы, такие как титан (Ti), цирконий (Zr) и гафний (Hf). Они отличаются своей химической реактивностью и физическими свойствами, а также радиусами атомов.
Радиус атомов металлов 4 класса увеличивается по мере движения от титана к гафнию. Титан имеет наименьший радиус атома в этой группе, а гафний - наибольший. Это связано с увеличением атомных ядер и добавлением электронов к энергетическим оболочкам.
Отличительной особенностью металлов 4 класса является их высокая плотность. Радиус атома влияет на плотность материала: чем больше радиус, тем более разреженной становится структура материала, что ведет к уменьшению плотности. Гафний, имеющий наибольший радиус атома, обладает самой низкой плотностью среди металлов этой группы.
Различия в радиусах атомов металлов 4 класса также влияют на их химическую активность. Чем больше радиус атома, тем "размягче" и более реакционно вещество. Таким образом, гафний, с наибольшим радиусом атома, имеет большую химическую активность по сравнению с титаном с наименьшим радиусом атома.
В таблице ниже представлены значения радиусов атомов металлов 4 класса, выраженные в пикометрах (1 пикометр = 1 × 10^-12 метра):
| Элемент | Радиус атома (пм) |
|---|---|
| Титан (Ti) | 147 |
| Цирконий (Zr) | 160 |
| Гафний (Hf) | 176 |
Данные значения наглядно демонстрируют увеличение радиусов атомов от титана до гафния в металлах 4 класса и важность этого параметра для их химических и физических свойств.
Металлы 5 класса: радиус атомов

Металлы 5 класса периодической системы элементов являются элементами переходных металлов и включают такие химические элементы, как ниобий (Nb), молибден (Mo), технеций (Tc), рений (Re) и дубний (Db). Каждый из этих элементов имеет свою особенность в строении своих атомов и радиусах.
Ниобий (Nb) - это мягкий металл серого цвета, который имеет один из самых высоких радиусов атомов среди всех элементов пятого класса. Его атомы обладают большим размером по сравнению с другими элементами этой группы. Радиус атома ниобия составляет около 146 пикометров.
Молибден (Mo) - это серебристо-серый металл, который имеет более компактные атомы, чем ниобий. Это делает его атомы меньше по сравнению с ниобием. Радиус атома молибдена составляет около 139 пикометров.
Технеций (Tc) - это искусственный элемент, у которого нет стабильных изотопов. Его атомы имеют еще меньший радиус по сравнению с молибденом. Радиус атома технеция составляет около 135 пикометров.
Рений (Re) - это серебристо-белый металл, который имеет наименьший радиус атомов среди всех элементов 5 класса. Радиус атома рения составляет около 135 пикометров.
Дубний (Db) - это синтетический элемент, который имеет очень большие атомы. Радиус атома дубния составляет около 128 пикометров.
Таким образом, радиус атомов металлов 5 класса уменьшается от ниобия к дубнию, с самым большим радиусом у ниобия и с самым маленьким радиусом у дубния.
Вопрос-ответ

Какие металлы относятся к классу s в периодической системе элементов?
К металлам класса s относятся литий (Li), натрий (Na), калий (K), магний (Mg), кальций (Ca) и другие элементы первой и второй групп периодической системы.
Как зависит радиус атомов металлов от их положения в периодической системе элементов?
Общая тенденция заключается в том, что радиус атомов металлов увеличивается по мере движения слева направо в периоде и уменьшается по мере движения сверху вниз в группе.
Почему радиус атомов металлов увеличивается по мере движения слева направо в периоде?
Это связано с увеличением заряда ядра атома и увеличением числа электронных оболочек. При увеличении заряда ядра притяжение электронов к ядру усиливается, что приводит к уменьшению радиуса атома.
Почему радиус атомов металлов уменьшается по мере движения сверху вниз в группе?
Это связано с добавлением новой электронной оболочки при движении вниз по группе. При добавлении новой оболочки увеличивается расстояние между ядром и электронами, что приводит к увеличению радиуса атома.
