Химия с элементами железа – одна из важных областей химической науки, которая изучает свойства и реакции соединений, содержащих в своем составе железо. Это многогранный предмет, затрагивающий различные аспекты химической реактивности, структуры и использования соединений с применением железа.
Задания по химии с элементами железа направлены на раскрытие знания студентов о реакциях, понимание свойств железа и его соединений, а также на развитие навыков работы с химическими формулами и уравнениями реакций. Они также помогают студентам изучить влияние различных факторов на химические процессы, таких как температура, давление, фазовое состояние вещества.
В заданиях по химии с элементами железа могут встречаться вопросы о свойствах и способах получения железа, его окислительно-восстановительных реакциях, описание и намерение реакций с железом, а также применение соединений с железом в промышленности и медицине.
Химические реакции с железом и его соединениями

Железо является одним из самых распространенных металлов на Земле и имеет широкий спектр применений в различных отраслях промышленности и быту. Химические реакции с железом и его соединениями играют важную роль в многих процессах.
Одной из наиболее известных химических реакций с железом является окисление железа при взаимодействии с кислородом воздуха. Это процесс называется ржавление. В результате реакции образуются оксиды железа, которые имеют красно-коричневый цвет. Ржавчина на поверхности железа является признаком разрушения металла и может привести к его деградации.
Железо также способно образовывать различные соединения с другими элементами. Например, взаимодействие железа с серной кислотой приводит к образованию сульфата железа. Это соединение широко используется в промышленности, а также в медицине и сельском хозяйстве.
Одной из важных реакций железа является его восстановление в присутствии водорода. В результате этой реакции образуется гидроксид железа, который в дальнейшем может быть использован для получения других соединений. Восстановление железа играет важную роль в процессе производства стали и других материалов на основе железа.
Химические реакции с железом и его соединениями имеют большое значение как с точки зрения научных исследований, так и в практическом применении. Изучение этих реакций позволяет расширить наши знания о свойствах и поведении железа, а также разрабатывать новые технологии и материалы на его основе.
Окисление железа в атмосферных условиях

Железо, будучи химическим элементом, имеет способность взаимодействовать с кислородом в атмосфере и подвергаться процессу окисления.
Окисление железа – это процесс, при котором железная поверхность приходит в контакт с кислородом из воздуха и образует оксидные пленки. В результате этого процесса, железо превращается в свои оксидные соединения – ржавчину.
Окисление железа воздухом является важным химическим процессом, который имеет практическое применение. Например, приготовление ржавчины для художественной работы или производства коммерческих оксидов железа.
Процесс окисления железа происходит в несколько стадий. Сначала железо покрывается оксидной пленкой, затем она взаимодействует с кислородом, образуя гидроксидно-оксидную фазу. После этого происходит образование гидратированной окиси железа, а затем окись железа вместе с углекислым газом образуют сульфат железа.
В целом, окисление железа в атмосферных условиях является неизбежным процессом, который приводит к образованию ржавчины. Для защиты металлов от окисления используют различные методы, такие как гальванизация и нанесение защитных покрытий.
Физико-химические свойства железосодержащих соединений
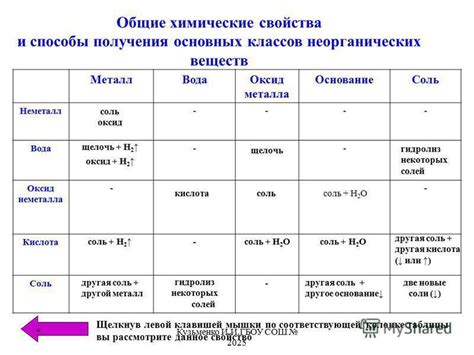
Железосодержащие соединения - это химические соединения, содержащие атомы железа как один из своих компонентов. Железо (Fe) является одним из самых распространенных элементов в земной коре и широко используется в различных отраслях промышленности и технологии.
Магнитные свойства. Железо является ферромагнетиком и обладает сильным магнитным свойством. Поэтому многие железосодержащие соединения также обладают магнитными свойствами. Некоторые из них могут быть даже постоянными магнитами или использоваться для создания магнитных материалов.
Окислительные свойства. Железо может образовывать соединения с различными химическими элементами, обладающие окислительными свойствами. Некоторые железосодержащие соединения могут быть использованы как катализаторы в химических реакциях, ускоряя процесс окисления других веществ.
Кислотные и основные свойства. Железо может образовывать как кислотные, так и основные соединения. Например, хлорид железа (III) (FeCl3) обладает кислотными свойствами и может реагировать с основаниями, образуя соли. С другой стороны, гидроксид железа (III) (Fe(OH)3) обладает основными свойствами и может реагировать с кислотами, образуя соли.
Растворимость. Растворимость железосодержащих соединений различна и зависит от их химического состава. Некоторые соединения, такие как сульфат железа (II) (FeSO4), хорошо растворяются в воде, в то время как другие, например оксид железа (Fe2O3), практически нерастворимы. Растворимость может изменяться в зависимости от pH раствора.
Применение железа в качестве катализатора

Железо является одним из наиболее распространенных элементов в природе и широко применяется в химической промышленности в качестве катализатора. Катализатор – это вещество, которое изменяет скорость химической реакции, не участвуя в ней самостоятельно.
Одним из ключевых аспектов применения железа в качестве катализатора является его способность к ферромагнетизму. Это свойство делает железо и его соединения высокоактивными катализаторами для различных процессов в химической промышленности.
Применение железа в качестве катализатора позволяет ускорить множество химических реакций и снизить энергозатраты на производство. Например, железо используется в процессе аммиачной синтеза, который является основным способом производства аммиака для удобрений и других химических продуктов.
Кроме того, железо применяется в катализаторах для окислительных реакций, таких как окисление алканов, алкенов и ароматических соединений. Это позволяет получать важные химические вещества, такие как ацетон, фталевый ангидрид, формальдегид и др.
Таким образом, применение железа в качестве катализатора имеет огромное значение для химической промышленности, позволяя снизить затраты на производство и повысить эффективность химических реакций.
Использование железа в процессе гальванического осаждения
Гальваническое осаждение является важным процессом, применяемым в различных отраслях промышленности и научных исследованиях. Одним из основных элементов, используемых при гальваническом осаждении, является железо.
Железо широко применяется в процессе гальванического осаждения благодаря своим уникальным свойствам. Оно обладает высокой электропроводностью, что позволяет использовать его в качестве анода или катода в электролитической ванне. Кроме того, железо является достаточно стабильным и устойчивым материалом, что обеспечивает эффективную и долговечную работу процесса гальванического осаждения.
Применение железа в гальваническом осаждении также обеспечивает возможность получения качественного покрытия. Железо обладает хорошей адгезией с различными материалами, что позволяет достичь прочного и равномерного покрытия поверхности. Это особенно важно при создании защитных покрытий для металлических изделий, таких как автомобильные детали или мебельные компоненты.
Гальваническое осаждение с использованием железа также может быть применено для создания декоративных покрытий. Железо позволяет получить разнообразные эффекты, такие как матовый, глянцевый или текстурированный вид поверхности. Это делает его особенно привлекательным для применения в создании украшений, электроники и других предметов, где важна не только функциональность, но и эстетический вид.
Таким образом, использование железа в процессе гальванического осаждения позволяет получить качественное, прочное и эстетически привлекательное покрытие на поверхности различных материалов. Это делает его важным элементом в различных отраслях исследований и промышленности.
Вопрос-ответ

Какие типы заданий по химии с элементами железа существуют?
Существует множество типов заданий по химии с элементами железа, включая задания на расчеты стехиометрических соотношений, задания на определение оксидационного состояния железа, задания на расчеты по количеству вещества, а также задания на решение химических уравнений с участием железа.
Какие свойства железа необходимо знать для выполнения заданий по химии?
Для выполнения заданий по химии с элементами железа необходимо знать такие свойства железа, как его атомный и молекулярный вес, его оксидационные состояния, его реакционную способность, а также его основные химические соединения и их свойства.
Какие задания по химии с элементами железа могут встретиться на экзамене?
На экзамене по химии могут встретиться задания на расчеты стехиометрических соотношений с участием железа, задания на определение оксидационного состояния железа в химических соединениях, задания на решение химических уравнений с участием железа, а также задания на расчеты по количеству вещества с участием железа.
Как можно применить знания по химии с элементами железа в жизни?
Знания по химии с элементами железа могут быть применены в жизни, например, при работе с металлическими изделиями из железа, при понимании процессов окисления и восстановления, при использовании железа в промышленных процессах, а также при изучении биохимических процессов, в которых участвует железо, таких как процессы кислородтранспорта в организме.
