Электрохимический ряд металлов является одним из важных понятий в химии и электрохимии. Он позволяет определить относительные электрохимические активности различных металлов и использовать эту информацию для проведения различных практических заданий.
Электрохимический ряд металлов упорядочивает металлы по их способности вступать в реакции окисления и восстановления. В ряду металлы располагаются в порядке возрастания их электрохимической активности. Таким образом, металлы, находящиеся выше в ряду, имеют большую активность и могут вступать в реакции с металлами, находящимися ниже в ряду.
Изучение электрохимического ряда металлов и проведение соответствующих практических заданий позволяет получить ценные знания о реакциях окисления и восстановления, а также о возможности использования различных металлов в электрохимических процессах, таких как производство электролитического цинка или гальванического покрытия.
В этой статье мы рассмотрим несколько интересных заданий для практики, которые помогут на практике освоить электрохимический ряд металлов и его применение. Мы узнаем, как провести эксперименты с различными металлами и определить их электрохимическую активность. В результате вы сможете лучше понять принципы химических реакций и их влияние на свойства и поведение металлов.
Понятие электрохимического ряда металлов
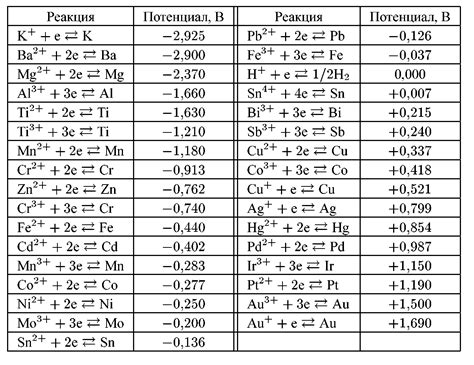
Электрохимический ряд металлов – это упорядоченный по убыванию потенциала окислительно-восстановительного воздействия металлов.
Электрохимический ряд металлов помогает определить, какой металл будет восстановителем при контакте с растворами солей других металлов.
Ряд составляется на основе потенциалов окисления металлов, которые можно найти в специальной таблице.
Металлы, находящиеся выше в ряду, имеют больший потенциал окисления и, соответственно, обладают большей склонностью к химическому окислению. Эти металлы могут выступать в качестве восстановителей.
Например, металл, находящийся выше железа в электрохимическом ряду, способен окислять его и вытеснять из растворов его солей.
В электрохимическом ряду также на основе потенциалов окисления металлов можно определить их способность к коррозии и деградации в окружающей среде.
Определение потенциала электродов

Потенциал электрода является мерой его способности принимать или отдавать электроны при взаимодействии с раствором. Определение потенциала электродов играет важную роль в электрохимии, так как позволяет оценить тенденции процессов окисления и восстановления различных веществ.
Существует несколько способов определения потенциала электродов. Одним из наиболее распространенных является сравнение их с потенциалом стандартного водородного электрода (SHE). Водородный электрод принят за стандарт и его потенциал равен нулю. Это позволяет сравнивать потенциалы других электродов относительно водородного электрода.
Для определения потенциала электрода необходимо провести эксперимент, в котором электрод помещается в раствор с известной концентрацией и потенциалом. Затем измеряется разность потенциалов между этим электродом и водородным электродом с использованием вольтметра. Полученное значение является потенциалом искомого электрода.
Определение потенциала электродов важно для понимания электрохимических процессов. Знание потенциалов позволяет прогнозировать направление и скорость реакций окисления и восстановления, а также проектировать и улучшать различные электрохимические системы, такие как батареи и преобразователи энергии.
Методы исследования электрохимического ряда
В электрохимии существуют различные методы исследования электрохимического ряда, которые позволяют определить активность металлов и их способность к окислению и восстановлению. Один из таких методов – определение электродного потенциала металла.
Для определения электродного потенциала металлов используется сравнение потенциалов их электродов с потенциалом стандартного электрода, который служит эталоном. Значение потенциала стандартного электрода вводится в электрохимической ячейке с тестируемым металлом, и с помощью вольтметра измеряется разность потенциалов, позволяющая определить активность металла.
Другим методом исследования электрохимического ряда является анализ газов, образующихся на электродах. В этом случае, происходит нагревание электрода в пламени горелки или в некотором закрытом объеме, и производится сбор, анализ и измерение образующихся газов, которые могут свидетельствовать о процессах окисления и восстановления металла.
Также к электрохимическим методам исследования относится использование фотогальванических ячеек. Данные ячейки позволяют создать замкнутую электрическую цепь между двумя различными металлами, и с помощью амперметра и вольтметра измерить электрический ток и разность потенциалов между металлами.
Применение электрохимического ряда в практике

Электрохимический ряд металлов - это упорядоченный список металлов, расположенных по величине их потенциала окисления. Применение электрохимического ряда в практике находит широкое применение в различных областях, таких как электрохимия, химический анализ, процессы гальванического покрытия и т.д.
Электрохимический ряд металлов позволяет предсказать возможность тех или иных электрохимических реакций. На основе данного ряда можно определить, какой металл будет окисляться, а какой будет восстанавливаться. Это особенно важно при проведении гальванических процессов, таких как гальваническое покрытие металлами.
Также электрохимический ряд металлов применяется в химическом анализе для определения содержания веществ в различных образцах. Например, если необходимо определить концентрацию ионов металла в растворе, то можно использовать реакцию, основанную на разности потенциалов указанного металла и реагента.
Кроме того, электрохимический ряд металлов находит применение в практике электрохимии. Он позволяет определить направление и интенсивность электронного потока при проведении электролизных процессов. Металлы, расположенные более высоко в ряду, имеют более положительный потенциал окисления и служат анодами, а металлы, расположенные более низко, имеют более отрицательный потенциал и являются катодами.
В целом, электрохимический ряд металлов является важным инструментом в практике, который позволяет предсказать и контролировать различные электрохимические реакции, а также применять его в химическом анализе и электрохимических процессах.
Решение задач по электрохимическому ряду металлов

Электрохимический ряд металлов — это упорядоченный список металлов по их способности участвовать в электрохимических реакциях. Он позволяет определить, какие металлы будут выступать в качестве анода и катода в гальванической или электролитической ячейке. Решение задач по электрохимическому ряду металлов требует знания основных правил и принципов, соблюдение которых поможет нам выявить правильное решение.
Одной из типичных задач по электрохимическому ряду металлов является определение того, какой металл может вытеснить другой из раствора своей соли. Для этого необходимо сравнить положение этих металлов в ряду. Металл, находящийся выше в ряду, обладает большей активностью и может вытеснить металл ниже. Важно помнить, что металлы справа в ряду обладают большей активностью, чем металлы слева.
В задачах на решение электрохимического ряда металлов также могут встречаться вопросы о том, какой металл будет выступать в качестве анода или катода в определенной электрохимической реакции. Для решения таких задач нужно сравнить электрохимический потенциал металлов. Металл с более положительным потенциалом будет выступать в качестве катода, а металл с более отрицательным потенциалом — в качестве анода.
В общем случае, для решения задач по электрохимическому ряду металлов, необходимо запомнить порядок металлов в ряду и знать основные принципы определения активности металлов и их роли в электрохимических реакциях. Это поможет правильно определить, какой металл может вытеснить другой из раствора или какие металлы могут участвовать в гальванической или электролитической ячейке.
Тесты на знание электрохимического ряда металлов
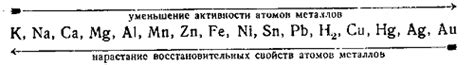
Электрохимический ряд металлов - это упорядоченный по убыванию потенциалов металлов список, с помощью которого можно предсказать, будет ли происходить электрохимическая реакция между двумя металлами или их соединениями. Для проверки знания электрохимического ряда металлов можно использовать различные тесты.
Одним из возможных тестов может быть предложение набора вопросов, в котором участнику необходимо указать порядок расположения металлов в электрохимическом ряду. Для этого можно предоставить список металлов и попросить участника упорядочить их согласно электрохимическому ряду. Это позволит проверить, насколько хорошо участник знает основные свойства металлов и их потенциалы.
Другой вариант теста может быть связан с предложением уравнений электрохимических реакций и требованием определить, какие металлы будут действовать в качестве анодов, а какие в качестве катодов. Для этого можно представить список уравнений реакций и попросить участника указать, какой металл будет окисляться (анод) и какой будет восстанавливаться (катод) в каждом уравнении. Такой тест поможет проверить понимание участником принципов работы электрохимической ячейки.
Также можно предложить тест, в котором участнику необходимо определить, какие элементы или их соединения будут реагировать с растворами солей других металлов. Для этого можно предоставить список растворов солей и попросить участника указать, с какими металлами или их соединениями будет происходить реакция. Такой тест поможет проверить знание участником реакций соляных электролитов и их взаимодействия с металлами.
С использованием подобных тестов можно проверить знание электрохимического ряда металлов и способность участника применять его в практических задачах. Тестирование поможет участнику лучше усвоить материал и научиться применять знания в практических ситуациях.
Примеры практических заданий для самостоятельной работы

1. Найдите элементы, которые могут быть использованы для анодной окислительной реакции и элементы, которые могут быть использованы для катодной восстановительной реакции на основе электрохимического ряда металлов. Составьте таблицу, указав соответствующие элементы и их окислительно-восстановительные свойства.
2. Изучите реакции между различными металлами и растворами солей других металлов. Определите, какие металлы обладают большей активностью и способны вытеснить другие металлы из их солей.
3. Проведите эксперимент, чтобы определить, как изменяется потенциал раствора при изменении концентрации ионов металлов в растворе. Запишите полученные данные и сделайте выводы о влиянии концентрации на потенциал раствора.
4. Проведите серию экспериментов, чтобы определить, как изменяется потенциал различных пар реакций, связанных с электрохимическим рядом металлов. Составьте графики или таблицу, отображающую полученные результаты.
5. Покажите, как изменяется направление потока электронов в электрохимической ячейке в зависимости от соотношения потенциалов реакций окисления и восстановления. Подтвердите свои выводы экспериментом.
Вопрос-ответ

Какие металлы входят в электрохимический ряд?
В электрохимическом ряду представлены различные металлы, такие как литий, калий, натрий, магний, алюминий, цинк, железо, медь, серебро, золото и другие.
Что показывает электрохимический ряд металлов?
Электрохимический ряд металлов показывает их относительную активность в реакциях окисления и восстановления. Металлы располагаются в ряду в порядке увеличения их склонности к тому, чтобы получить электроны, т.е. к восстановлению, то есть активные металлы находятся в верхней части ряда, а менее активные металлы - в нижней части.
Для чего используется электрохимический ряд металлов?
Электрохимический ряд металлов используется для определения возможности и направления протекания реакций окисления-восстановления. Он позволяет предсказать, будет ли реакция между двумя металлами протекать или нет, и если протекает, то в каком направлении. Также используя электрохимический ряд, можно сравнивать относительную активность металлов и предсказывать их поведение в различных химических реакциях.
Можно ли изменить положение металла в электрохимическом ряду?
Положение металла в электрохимическом ряду невозможно изменить, так как оно определяется его физическими и химическими свойствами. Однако, при определенных условиях можно изменить активность металла, например, путем введения катализатора или изменения концентрации раствора. Это может повлиять на скорость реакции, но не изменит положение металла в ряду.
