Щелочноземельные металлы - это группа элементов в периодической системе, которая включает бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы обладают рядом уникальных химических и физических свойств и широко применяются в различных сферах нашей жизни. Задачи, связанные с щелочноземельными металлами, могут быть интересными для студентов и профессионалов в области химии и материаловедения.
Одной из задач, которую ставят перед собой исследователи, является разработка новых материалов и сплавов на основе щелочноземельных металлов. Эти материалы могут обладать уникальными физическими и химическими свойствами и находить применение в различных отраслях промышленности, включая авиацию, электронику и медицину. Задача состоит в том, чтобы найти оптимальное сочетание элементов и определить условия их синтеза.
Другая важная задача, связанная с щелочноземельными металлами, заключается в разработке новых методов очистки и консервации металлических поверхностей. Щелочноземельные металлы, такие как кальций и барий, обладают хорошими антикоррозионными свойствами и могут использоваться для создания защитных покрытий. Задача включает в себя выбор оптимальных условий для нанесения покрытий и разработку методов контроля их качества.
Задачи по щелочноземельным металлам
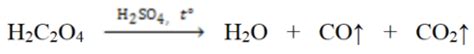
Щелочноземельные металлы - это элементы, которые находятся во второй группе периодической таблицы, после щелочных металлов. К ним относятся бериллий, магний, кальций, стронций, барий и радий. Задачи, связанные с этими элементами, позволяют углубиться в изучение их свойств и химических реакций.
Одна из задач может состоять в определении электронной конфигурации щелочноземельного металла. Для этого требуется знание расположения электронных оболочек и правил заполнения. Важно помнить, что электронная конфигурация шестью первыми элементами группы (бериллия, магния, кальция, стронция, бария и радия) имеет общую формулу ns^2.
Другая задача может заключаться в определении периодической закономерности в свойствах щелочноземельных металлов. Например, можно сравнить их химическую активность с щелочными металлами и сделать выводы о том, что химическая активность щелочноземельных металлов уменьшается с увеличением атомного номера.
Также возможны задачи, связанные с реакционной способностью щелочноземельных металлов. Например, можно предложить решить задачу о реакции бериллия с водой. Обычно бериллий не реагирует с водой, но при нагревании он образует оксид и водород. Задача заключается в написании уравнения реакции и объяснении причины такой реакционной способности.
Таким образом, задачи по щелочноземельным металлам помогают углубиться в изучение их химических свойств и усвоить периодическую систему элементов. Решение таких задач требует знания основ химии и периодической системы элементов.
Свойства щелочноземельных металлов

Щелочноземельные металлы - это группа элементов в периодической таблице, включающая бериллий, магний, кальций, стронций, барий и радий. У них есть несколько общих свойств, которые делают их уникальными и полезными для различных промышленных и научных приложений.
1. Атомные свойства: Щелочноземельные металлы имеют два электрона в своей внешней электронной оболочке и образуют двойные положительные ионы при ионизации. Это делает их сверхстабильными и неактивными химическими веществами.
2. Физические свойства: Щелочноземельные металлы обладают мягкостью и низкой плотностью. Они легко режутся ножом и могут быть натерты на порошок. Кроме того, они обладают высокой теплопроводностью и электропроводностью.
3. Химические свойства: Щелочноземельные металлы реагируют с водой, образуя щелочные гидроксиды и высвобождая водород. Они также реагируют с кислородом, образуя оксиды металлов. Эти реакции очень быстрые и сопровождаются выделением тепла и света.
4. Использование: Щелочноземельные металлы используются в различных сферах, таких как производство сплавов, производство огнеупорных материалов, производство батарей, производство косметических продуктов и других химических соединений. Они также используются в медицине и сельском хозяйстве.
В целом, щелочноземельные металлы имеют широкий спектр свойств и имеют множество промышленных и научных приложений. Изучение этих свойств помогает понять и использовать их в различных областях науки и техники.
Различия между щелочноземельными металлами

Щелочноземельные металлы - это группа химических элементов второй группы периодической системы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У этих металлов есть некоторые общие свойства, но также существуют различия между ними.
1. Физические свойства: Щелочноземельные металлы имеют серебристый оттенок и хорошую теплопроводность. Они имеют низкую плотность и точку плавления, что делает их легкими и мягкими металлами. Однако, у них различается плотность и температура плавления. Например, бериллий является самым легким и плотным щелочноземельным металлом, а стронций имеет самую низкую температуру плавления.
2. Химические свойства: Щелочноземельные металлы имеют два электрона в своей внешней электронной оболочке, что делает их химически активными. Однако, у них различные степени реактивности. Например, бериллий является наименее реактивным металлом в этой группе, а радий является самым реактивным.
3. Использование: Щелочноземельные металлы имеют различные применения в промышленности и научных исследованиях. Например, магний используется в производстве легких сплавов, бериллий используется в ядерной энергетике, а кальций используется в производстве строительных материалов.
4. Распространенность: Щелочноземельные металлы имеют различную распространенность в земной коре. Например, магний и кальций являются наиболее распространенными элементами этой группы, в то время как бериллий и радий встречаются в земной коре в незначительных количествах.
Итоги: Щелочноземельные металлы имеют сходные физические и химические свойства, но при этом различия в их плотности, температуре плавления, реактивности и распространенности. Эти различия определяют их применение в различных областях промышленности и научных исследованиях.
Процессы экстракции щелочноземельных металлов

Щелочноземельные металлы - это элементы, входящие во вторую группу периодической таблицы, а именно: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают рядом уникальных свойств, делающих их важными в различных областях промышленности и научных исследований.
Процесс экстракции щелочноземельных металлов является одним из наиболее распространенных способов получения чистых веществ. Он основан на использовании растворителей, которые обладают способностью вытеснять щелочноземельные металлы из их соединений.
Один из наиболее распространенных методов экстракции щелочноземельных металлов - это использование экстрактантов. Экстрактанты - это вещества, которые способны образовывать комплексы с щелочноземельными металлами и вытеснять их из растворов. Например, органические фосфорные кислоты, такие как ди(2-этилгексил) фосфорная кислота (D2EHPA), широко применяются в процессе экстракции магния и бериллия.
Кроме того, существуют методы экстракции щелочноземельных металлов с использованием ионных жидкостей. Ионные жидкости - это специальные типы растворителей, состоящих из ионов, которые могут эффективно растворять и вытеснять металлы из их соединений. Например, ионные жидкости на основе галогенидов щелочноземельных металлов могут быть использованы для экстракции бария и стронция.
Таким образом, процессы экстракции щелочноземельных металлов являются важным инструментом в современной химии и промышленности. Они позволяют получать чистые соединения этих металлов с высокой степенью чистоты и эффективностью.
Применение щелочноземельных металлов в промышленности

Щелочноземельные металлы – это группа элементов, которые широко используются в промышленности благодаря своим уникальным свойствам. Они включают в себя бериллий, магний, кальций, стронций, барий и радий. Эти металлы обладают высокой химической активностью, низкой плотностью и хорошей электропроводностью.
Один из применений щелочноземельных металлов - производство сплавов и различных металлических материалов. Например, бериллий используется при создании легких и прочных сплавов, которые находят применение в авиационной и автомобильной промышленности. Магний является основой для создания алюминиевых сплавов, которые широко применяются в строительстве и производстве транспортных средств.
Щелочноземельные металлы также находят применение в производстве стекла и керамики. Кальций является основным компонентом стекла, а стронций и барий используются для придания определенных характеристик стеклу, таких как прозрачность и прочность. Кроме того, эти металлы также используются в производстве глины и керамических изделий.
Еще одним применением щелочноземельных металлов является производство специальных смазочных материалов. Барий и стронций используются для создания специальных смазочных добавок, которые применяются в автомобильной промышленности. Эти добавки позволяют увеличить смазывающие свойства масел и снизить трение в двигателях.
В заключение, щелочноземельные металлы играют важную роль в промышленности благодаря своим уникальным свойствам. Они находят применение в производстве сплавов, стекла, керамики и смазочных материалов. Использование этих металлов позволяет создавать более легкие и прочные материалы, а также улучшать характеристики различных изделий.
Химические реакции металлов с водой и кислотами

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, взаимодействуют с водой и кислотами, образуя различные химические реакции.
С реакцией металлов с водой часто связывают выделение пузырьков водорода. Например, магний реагирует с водой, образуя оксид магния и выделяя молекулы водорода:
Магний + вода → оксид магния + водород
Реакция магния с водой протекает достаточно медленно и требует подогрева, однако при присутствии кислоты происходит значительное ускорение этой реакции.
Взаимодействие металлов с кислотами, например, с соляной кислотой или серной кислотой, также сопровождается образованием водорода. Например, реакция магния с соляной кислотой можно записать следующим образом:
Магний + соляная кислота → хлорид магния + водород
Когда металл реагирует с кислотой, он вытесняет водород из кислоты и образует соль, которая остается в растворе.
Такие реакции являются типичными для щелочноземельных металлов и имеют важное промышленное значение. Например, магний, реагируя с соляной кислотой, образует хлорид магния – важное соединение, которое применяется в производстве лекарств, сольвадиса и других химических продуктов.
- При реакции металла с водой или кислотой обычно выделяется водород
- Реакции металлов с водой/кислотами проходят быстрее при повышенной температуре
- Магний, кальций, стронций и барий – щелочноземельные металлы, образующие соли с кислотами
Химические свойства оксидов щелочноземельных металлов

Оксиды щелочноземельных металлов представляют собой химические соединения, состоящие из щелочноземельного металла и кислорода. Они обладают рядом уникальных химических свойств, которые определяют их роль в различных процессах и применение в различных областях.
Первое химическое свойство оксидов щелочноземельных металлов заключается в их способности образовывать щелочные растворы при контакте с водой. Это связано с высокой основностью оксидов, вызванной наличием щелочноземельного металла в соединении. При реакции оксида с водой образуется гидроксид металла и высвобождается энергия. Например, реакция между оксидом кальция (CaO) и водой приводит к образованию гидроксида кальция (Ca(OH)2) и выделению тепла.
Второе химическое свойство оксидов щелочноземельных металлов связано с их способностью образовывать соли при реакции с кислотами. При этом оксиды выступают в роли оснований, образуя ионные соединения с кислотными радикалами. Например, реакция между оксидом магния (MgO) и соляной кислотой (HCl) приводит к образованию соли хлорида магния (MgCl2) и выделению воды.
Третье химическое свойство оксидов щелочноземельных металлов проявляется в их способности связываться с другими веществами и образовывать сложные соединения. Например, оксид кальция (CaO) может реагировать с диоксидом углерода (CO2) при высоких температурах, образуя карбонат кальция (CaCO3), который является одним из основных компонентов мрамора.
Четвёртое химическое свойство оксидов щелочноземельных металлов заключается в возможности использования этих соединений в качестве катализаторов при различных химических реакциях. Оксиды щелочноземельных металлов обладают высокой активностью и способностью активизировать различные молекулы, что позволяет ускорить химические превращения и повысить эффективность реакции.
Химические свойства оксидов щелочноземельных металлов делают их важными для множества промышленных процессов и технологий. Они широко применяются в производстве стекла, строительных материалов, керамики, водопроводных систем, лекарственных препаратов и других отраслях промышленности.
Щелочноземельные металлы в биологии и медицине

Щелочноземельные металлы - это элементы, которые находятся во второй группе периодической таблицы. В биологии и медицине они играют важную роль и имеют различные применения.
Кальций, один из щелочноземельных металлов, является необходимым элементом для строения костей и зубов. Он участвует в многих биохимических процессах в организме, включая сокращение мышц и функцию нервной системы. Кальций также используется в медицине для лечения остеопороза и других заболеваний связанных с костями.
Магний в организме играет роль во многих ферментативных реакциях и является необходимым для нормального функционирования мышц и нервной системы. Он также способствует укреплению иммунной системы и регулирует сердечный ритм. В медицине магний используется для лечения мышечных судорог, астмы и проблем с сердцем.
Барий используется в медицине в качестве контрастного вещества для рентгеновских исследований желудочно-кишечного тракта и других органов. Барий обладает свойством поглощать рентгеновское излучение, что позволяет получить более точную картину органов и определить наличие заболеваний.
Стронций является частью структуры костей и зубов, подобно кальцию. Он также применяется в медицинской технике для создания стентов и имплантатов, которые помогают восстанавливать поврежденные кости и суставы. Стронций также используется в радиологических исследованиях, а также в приборах для определения прочности материалов.
Таким образом, щелочноземельные металлы имеют широкие применения в биологии и медицине. Они необходимы для нормального функционирования организма, их соединения используют в качестве лекарственных препаратов, конрастных веществ и для создания медицинской техники.
Вопрос-ответ

Какие основные свойства щелочноземельных металлов?
Основные свойства щелочноземельных металлов — высокая реакционная способность, металлический блеск, низкая плотность, низкая температура плавления, хорошая теплопроводность.
Какие примеры задач можно решить с использованием щелочноземельных металлов?
Примеры задач, связанных с щелочноземельными металлами: расчет массы вещества при заданном количестве атомов или массе атома, нахождение суммарного заряда и магнитных моментов, решение уравнений реакций с участием щелочноземельных металлов.
Какие реакции могут происходить с участием щелочноземельных металлов?
Реакция щелочноземельных металлов с кислородом — образование щелочноземельных оксидов. Реакция с водой — образование щелочноземельных гидроксидов и выделение водорода. Реакция со соляной кислотой — образование щелочноземельных хлоридов и выделение водорода.
Какая связь между реакцией щелочноземельного металла с водой и его электрохимическим потенциалом?
Связь между реакцией щелочноземельного металла с водой и его электрохимическим потенциалом состоит в том, что чем ниже электрохимический потенциал металла, тем более реакционноспособное он является и быстрее реагирует с водой.
