Химия – одна из основных естественных наук, изучающих вещества, их свойства, структуру и превращения. В области химии особое внимание уделяется взаимодействию металлов. Металлы – это элементы, характеризующиеся высокой электропроводностью, блестящей поверхностью и способностью образовывать ионы положительного заряда, или катионы.
Взаимодействие металлов – это процессы, при которых металлы образуют химические соединения с различными веществами. Например, металлы могут реагировать с кислородом, окисляясь и образуя металлические оксиды. Также металлы могут образовывать соединения с неметаллами, образуя соли.
Задачи по химии на взаимодействие металлов позволяют развить навыки расчета стехиометрических соотношений, определения окислительно-восстановительных свойств, анализа реакций и многое другое. Решая такие задачи, можно углубить свои знания по химии и научиться применять их на практике.
Взаимодействие металлов: задачи и решения в химии

Задача 1: Рассмотрим взаимодействие алюминия с железной(II) солью:
- Напишите уравнение реакции, происходящей между алюминием и железной(II) солью.
- Какие вещества образуются в результате данной реакции?
- Какие ионы участвуют в окислительно-восстановительной реакции?
- Какой будет степень окисления у железа в образовавшемся соединении?
Решение:
- Уравнение реакции: 2Al + 3FeCl2 = 2AlCl3 + 3Fe.
- В результате данной реакции образуются алюминий хлорид и железо.
- Ионы алюминия и ионы железа.
- Степень окисления железа в образовавшемся соединении равна 0.
Задача 2: Рассмотрим взаимодействие цинка с серной(IV) солью:
- Напишите уравнение реакции, происходящей между цинком и серной(IV) солью.
- Какие вещества образуются в результате данной реакции?
- Какие ионы участвуют в окислительно-восстановительной реакции?
- Какой будет степень окисления серы в образовавшемся соединении?
Решение:
- Уравнение реакции: Zn + H2SO4 = ZnSO4 + H2.
- В результате данной реакции образуются цинксульфат и водород.
- Ионы цинка и ионы серы.
- Степень окисления серы в образовавшемся соединении равна +6.
Определение порядка реактивности металлов
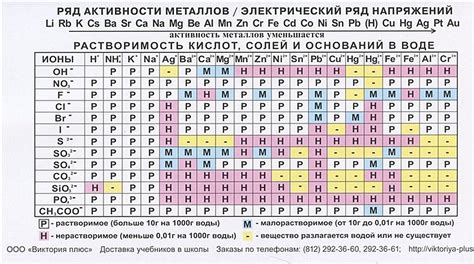
Порядок реактивности металлов важен для понимания и предсказания результатов различных химических реакций. Реактивность металлов определяется их способностью вступать в химические реакции с другими веществами.
Реактивность металлов может быть определена по нескольким критериям. Один из таких критериев - способность металла вытеснять другой металл из его соединения. Если металл A может вытеснить металл B из его соединения, то можно сказать, что металл A более реактивен, чем металл B.
Другой критерий определения реактивности металлов - их способность реагировать с кислородом воды или водными растворами кислот. Некоторые металлы, такие как натрий или калий, реагируют с кислородом воды быстро и ярко, тогда как другие металлы, такие как железо или цинк, реагируют медленно или не реагируют вообще.
В таблице реактивности металлов, металлы обычно располагают в порядке убывания их реактивности. Наиболее реактивные металлы находятся в верхней части таблицы, а наименее реактивные - в нижней части. Это позволяет определить, какой металл может вытеснить другой из его соединения и какие реакции могут происходить или не происходить с участием определенного металла.
Как решать задачи по взаимодействию металлов с кислотами
Взаимодействие металлов с кислотами является одной из важных тем в химии. Для успешного решения задач по этой теме нужно учитывать несколько ключевых аспектов.
Во-первых, необходимо знать, какие металлы образуют соли и выделяются газы при их взаимодействии с кислотами. Например, металлы первой группы, такие как натрий, калий и литий, реагируют с кислотами, образуя соли и выделяя водород. Вторая группа металлов, включая магний и цинк, образуют соли и выделяются водородом только при нагревании.
Во-вторых, необходимо знать химические уравнения реакций металлов с кислотами. Например, реакция цинка с соляной кислотой можно представить следующим уравнением:
Zn + 2HCl -> ZnCl2 + H2
Если в задаче указаны начальные концентрации реагентов, то можно использовать балансирование уравнений и расчеты по количеству веществ.
Обратите внимание на применение правила вяжущей группы: при реакции металла с кислотой, где ион металла имеет несколько степеней окисления, наибольшую активность проявляет ион с наименьшей положительной зарядностью.
Очень важно также знать реакцию между металлом и кислотой для определения последовательности реакций в системах, содержащих несколько металлов и кислоты. Для этого можно использовать данные по активности металлов в реакциях с кислотами, которые представлены в таблице активности.
В итоге, для успешного решения задач по взаимодействию металлов с кислотами необходимо учесть тип металла и кислоты, их концентрации, знать химические уравнения реакций, а также использовать информацию по активности металлов и правило вяжущей группы.
Идентификация металлов с помощью простейших реакций
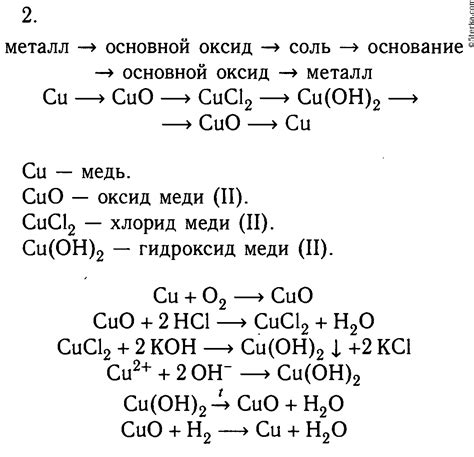
Идентификация металлов – это процесс определения типа и свойств металла на основе его химических реакций. Это важная задача в химии, так как позволяет распознать и охарактеризовать различные металлические материалы.
Для идентификации металлов часто используют простейшие реакции, которые характерны для определенных типов металлов. Например, реакция с кислотой или взаимодействие с растворителями может помочь определить присутствие определенного металла.
Одним из распространенных способов идентификации металлов является реакция с кислотой. Для этого на металл помещают немного кислоты, например, соляной или уксусной. Если между металлом и кислотой происходит химическая реакция, то можно сделать вывод о наличии конкретного металла. Например, если металл растворяется под выделение пузырьков газа, можно предположить, что реагентом является цинк.
Другим способом идентификации металлов является их взаимодействие с растворителями. Некоторые металлы реагируют с водой или другими растворителями, образуя характерные соединения. Например, активные металлы, такие как натрий или калий, реагируют с водой, выделяя гидроген.
В итоге, идентификация металлов с помощью простейших реакций позволяет определить тип и свойства металла на основе его химического взаимодействия с другими веществами. Это важный инструмент в научных и промышленных исследованиях, а также в повседневной химической практике.
Задачи по растворению металлов в различных растворителях

Растворение металлов в различных растворителях является одной из важных задач в химии. Это процесс, в результате которого металлы переходят в ионное состояние, образуя ионы металла. Задачи, связанные с растворением металлов, позволяют изучить взаимодействие металлов с различными веществами и определить их реакционную способность.
Одной из задач по растворению металлов является определение их реакционной способности в различных растворителях. Для этого проводятся эксперименты, в которых металлы помещают в разные растворы и наблюдают за их взаимодействием. В результате проведения таких экспериментов можно определить, какие металлы активно растворяются в определенных растворителях, а какие наоборот, не взаимодействуют с ними.
В задачах по растворению металлов можно также рассматривать влияние различных факторов на скорость реакции растворения. Например, можно изучать, как меняется скорость растворения металлов в зависимости от температуры или концентрации раствора. Такие задачи позволяют лучше понять кинетические особенности реакции растворения и определить оптимальные условия для проведения таких реакций.
В итоге, задачи по растворению металлов в различных растворителях позволяют изучить влияние металлов на окружающую среду, определить их реакционную способность и кинетические особенности реакции растворения. Это важные задачи в химии, которые помогают расширить наши знания об ионных реакциях и взаимодействии металлов с другими веществами.
Взаимодействие металлов с окислителями и восстановителями

Взаимодействие металлов с окислителями и восстановителями является важной частью изучения химии. Окислители и восстановители, такие как кислород, кислоты, соли, пероксиды и другие вещества, могут вызывать химические реакции, в процессе которых металлы могут потерять или получить электроны.
Взаимодействие металлов с окислителями называется окислительной реакцией. В результате таких реакций металлы могут окисляться, терять электроны и образовывать положительно заряженные ионы. Например, реакция алюминия с кислородом приводит к образованию оксида алюминия:
4Al + 3O2 → 2Al2O3
Возможность металлов взаимодействовать с окислителями может зависеть от их электрохимического потенциала. Некоторые металлы, такие как натрий и калий, имеют высокий электрохимический потенциал и легко реагируют с окислителями, в то время как другие металлы, такие как серебро и золото, имеют низкий электрохимический потенциал и реагируют с окислителями менее активно.
С другой стороны, взаимодействие металлов с восстановителями, такими как водород, натрий боргидрид или молибден, приводит к обратному процессу - металлы могут получать электроны и образовывать отрицательно заряженные ионы. Например, реакция натрия с водородом приводит к образованию гидрида натрия:
2Na + H2 → 2NaH
Взаимодействие металлов с окислителями и восстановителями имеет важное практическое значение. Например, в процессе гальванической коррозии металлы могут выступать в роли анодов и катодов и выделяться из раствора в виде ионов. Эти реакции широко используются в электрохимических элементах, батарейных технологиях и других процессах.
Комплексообразование и задачи по взаимодействию металлов с лигандами
Комплексообразование - это процесс образования сложных соединений, называемых комплексами, между металлами и лигандами. Лиганды - это атомы или группы атомов, обладающие свободными электронными парами, которые могут образовывать связи с металлическими ионами.
Взаимодействие металлов с лигандами имеет ряд важных задач. Во-первых, оно позволяет изучить способность металлов образовывать комплексы и их стабильность. Это особенно важно для использования металлов в качестве катализаторов или в медицине, где стабильность комплексов может влиять на их эффективность.
Во-вторых, задачи по взаимодействию металлов с лигандами помогают определить структуру комплексных соединений. Изучение строения исходных металлических ионов и их комплексов позволяет установить связи между структурой и свойствами соединений, а также предсказывать их реакционную активность.
Также, взаимодействие металлов с лигандами позволяет исследовать взаимодействие солнечного света с комплексами, что имеет важное значение в фотохимии и фотоэлектрохимии. Солнечная энергия может быть использована для преобразования в химическую энергию при помощи специальных фотохимических реакций, которые происходят с участием комплексов металлов и лигандов.
В целом, изучение комплексообразования и задач по взаимодействию металлов с лигандами позволяет более глубоко понять химические свойства металлов, их роль в различных реакциях и применение в различных отраслях науки и промышленности.
Вопрос-ответ

Какие задачи по химии с взаимодействием металлов можно решить?
Задачи по химии с взаимодействием металлов могут касаться различных аспектов этого процесса, например, рассчитать степень окисления металла, определить продукты реакции между металлом и кислотой, или решить задачу на определение потенциала водородного электрода (pH). Возможно также решение задач по расчету стехиометрии взаимодействия металлов, анализу электрохимических реакций или решение задач по гальваническим элементам.
Как решить задачу по определению продуктов реакции между металлом и кислотой?
Для решения такой задачи необходимо знать ряд активности металлов и уметь определять, какой металл будет активнее при взаимодействии с кислотой. Если металл в ряду активности выше, то он сможет вытеснить металл ниже и образовать продукт реакции. Если металл не находится в ряду активности, то решение задачи может потребовать применения принципов химической термодинамики и вычисления потенциала электродов.
