Задачи на эквивалент металла по водороду являются одним из основных инструментов для определения активности металлов. Эта задача заключается в определении массы металла, которая может высвободить заданное количество водорода при реакции. Решение таких задач требует знания химических реакций между металлами и водородом, а также умения проводить расчеты на основе их массы и эквивалентов.
Первый шаг при решении задачи на эквивалент металла по водороду - определение химической реакции между металлом и водородом. Во время этой реакции образуется водородный газ и соответствующая соль металла. Необходимо знать химическую формулу металла, чтобы установить соответствующую массу и эквивалент металла.
Второй шаг - определение эквивалента водорода. Эквивалент водорода определяется как масса водорода, высвободившаяся при реакции с одним эквивалентом металла. Этот показатель может быть вычислен с использованием химического уравнения реакции и молярной массы водорода.
Третий шаг - определение эквивалента металла. Эквивалент металла вычисляется путем деления массы металла на эквивалент водорода. Полученное значение является эквивалентом металла, который можно использовать для решения задач на эквивалент металла по водороду. Эта величина позволяет определить массу металла, необходимую для высвобождения заданного количества водорода при реакции.
Методы решения задачи на эквивалент металла по водороду

Задача на определение эквивалента металла по водороду является одной из основных задач химического анализа. Для ее решения существует несколько методов, которые основаны на разных принципах и подходах.
1. Метод действующих соотношений: при использовании этого метода известное количество металла реагирует с известным объемом водорода. Исходя из соотношения между реагирующими веществами, можно вычислить эквивалент металла по водороду.
2. Метод гравиметрии: этот метод основан на определении массы образовавшегося при реакции металла гидрида. Измеряя массу гидрида и зная его химическую формулу, можно вычислить эквивалент металла.
3. Метод растворимости: данный метод заключается в растворении известного количества металла в кислоте и реагировании с избытком водорода. После окончания реакции, определяя количество неиспользованного водорода, можно вычислить эквивалент металла.
4. Метод вольтамперометрии: данный метод основан на измерении электрической активности металла в растворе. Используя уравнение Нернста и значения электродного потенциала, можно определить эквивалент металла по водороду.
Таким образом, существует несколько методов решения задачи на эквивалент металла по водороду, которые позволяют с высокой точностью определить этот параметр. Выбор метода зависит от условий проведения анализа и доступных лабораторных средств.
Как использовать нормативные данные для расчета эквивалента металла по водороду
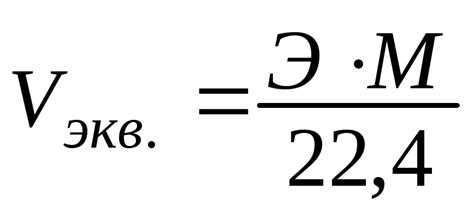
Расчет эквивалента металла по водороду осуществляется на основе нормативных данных, которые устанавливают предельное содержание водорода в металле для обеспечения его надежности и безопасности в использовании.
Для начала необходимо определить химический элемент металла и ознакомиться с соответствующими нормативными документами. В них указывается максимально допустимое содержание водорода, которое может находиться в металлическом изделии.
После определения нормативных значений следует провести анализ содержания водорода в данном металле. Для этого используются специальные методы и инструменты, такие как газовый хроматограф и спектрометр, которые позволяют точно определить концентрацию водорода в образце металла.
Затем производится расчет эквивалента металла по формуле, которая учитывает максимально допустимое содержание водорода и фактическую концентрацию в образце. Результатом расчета является величина эквивалента металла, которая показывает, насколько данный металл способен взаимодействовать с водородом и выдерживать его воздействие.
Полученные данные о эквиваленте металла по водороду могут быть использованы в процессе проектирования и изготовления изделий, а также при проведении диагностических и испытательных работ. Это позволяет гарантировать безопасность и надежность использования металлических конструкций в условиях, где возможно наличие водорода.
Примеры расчета эквивалента металла по водороду

Расчет эквивалента металла по водороду является важным этапом при решении задач, связанных с водородным состоянием металлов. Эквивалент металла по водороду определяется по соотношению между количеством водорода и массой металла, участвующего в реакции.
Примером расчета эквивалента металла по водороду может служить задача об определении эквивалента железа (Fe) по водороду. Предположим, что имеется 5 г чистого железа, которое вступает в реакцию с водородом. Известно, что в результате реакции образуется 4 г воды (H2O). Согласно химическому уравнению реакции, на одну моль железа приходится 1 моль водорода. Таким образом, эквивалент железа по водороду равен 1.
Другой пример может быть связан с расчетом эквивалента цинка (Zn) по водороду. Предположим, что имеется 10 г цинка, который реагирует с водой (H2O). В результате реакции образуется 5 г водорода (H2). Исходя из химического уравнения реакции, каждая моль цинка вступает в реакцию с двумя молями водорода. Следовательно, эквивалент цинка по водороду составляет 2.
Таким образом, расчет эквивалента металла по водороду позволяет оценить количество металла, участвующего в реакции с водородом. Это важно для проведения химических расчетов и анализа водородных свойств металлов.
Особенности задачи на эквивалент металла по водороду в разных сферах

Задачи на эквивалент металла по водороду являются важными в различных сферах промышленности и научных исследований. Этот параметр позволяет определить количество водорода, которое может быть поглощено или испущено металлическим материалом.
Одна из сфер, где встречаются такие задачи, - это материаловедение. Здесь эквивалент металла по водороду является важным показателем для оценки влияния водорода на металлические конструкции. Это особенно актуально при выборе материалов для использования в условиях, где есть риск коррозии под воздействием водорода, например, в нефтегазовой отрасли.
В авиационной и космической отраслях, эквивалент металла по водороду является важным фактором при разработке и тестировании материалов, используемых в изготовлении летательных аппаратов. Предотвращение коррозии и разрушения металла под воздействием водорода является критическим требованием для обеспечения безопасности и надежности авиационных и космических систем.
Кроме того, задачи на эквивалент металла по водороду актуальны и в энергетической отрасли. При работе с водородом, который широко используется в перспективных технологиях водородной энергетики, необходимо учитывать его взаимодействие с металлическими материалами. Оценка эквивалента металла по водороду позволяет предупредить возможные проблемы и повысить безопасность водородных систем.
Вопрос-ответ

Что такое эквивалент металла по водороду?
Эквивалент металла по водороду - это масса металла, способная взаимодействовать с определенным количеством водорода при заданных условиях.
Как решить задачу на эквивалент металла по водороду?
Для решения задачи на эквивалент металла по водороду, необходимо знать массу металла и количество водорода, с которым взаимодействует этот металл. Затем можно использовать соотношение массы металла и количества водорода, чтобы найти эквивалент металла.
Какую формулу использовать для решения задачи на эквивалент металла по водороду?
Формула, которую можно использовать для решения задачи на эквивалент металла по водороду, зависит от данной конкретной задачи. Обычно используется формула: эквивалент металла = (масса металла * 2) / количество водорода.
Какая информация необходима для решения задачи на эквивалент металла по водороду?
Для решения задачи на эквивалент металла по водороду необходимо знать массу металла и количество водорода, с которым взаимодействует этот металл. Также обычно нужно знать плотность металла и его молярную массу.
